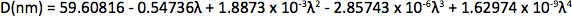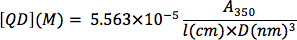الكم النقاط المدمجة لواحدة جزيء التصوير
Summary
وصفنا إعداد نقاط الكم الغروية مع حجم مصغر لتصوير الهيدروديناميكية مضان واحدة جزيء. مقارنة نقاط الكم التقليدية، هذه الجسيمات النانوية هي مماثلة في الحجم إلى البروتينات الكروية وهي الأمثل لواحدة جزيء السطوع والاستقرار ضد التحلل الضوئي، ومقاومة غير محددة ملزمة للبروتينات وخلايا.
Abstract
واحدة جزيء التصوير أداة مهمة لفهم آليات وظيفة الجزيئية البيولوجية والرؤية وعدم التجانس المكاني والزماني من السلوكيات الجزيئي التي تكمن وراء البيولوجيا الخلوية 1-4. الصورة لجزيء الفردية للمصلحة، فمن عادة مترافق إلى علامة فلوري (صباغة، البروتين، وحبة، أو الكم نقطة)، ولاحظ مع epifluorescence أو الكلي المجهر التأمل الداخلي (TIRF) مضان. بينما الأصباغ والبروتينات الفلورية كانت الدعامة الأساسية لمضان التصوير على مدى عقود، من مضان غير مستقر في ظل تدفقات عالية الفوتون اللازمة لمراقبة الجزيئات الفردية، مما أسفر سوى بضع ثوان للمراقبة قبل فقدان كامل للإشارة. حبات الخرز والمطاط صبغ المسمى توفير الاستقرار تحسنت إشارة لكن على حساب حجم أكبر بشكل كبير الهيدروديناميكية التي يمكن أن تغير deleteriously نشر وسلوك جزيء قيد الدراسة
ntent "> نقاط الكم (QDs) توفر التوازن بين هذين النظامين للمشاكل. وتتكون هذه الجسيمات النانوية من المواد أشباه الموصلات ويمكن هندستها مع الحجم الصغير مع المقاومة hydrodynamically استثنائية للتحلل الضوئي 5. وهكذا في السنوات الأخيرة كان لها دور أساسي QDs في تمكين على المدى الطويل مراقبة سلوك الجزيئات المعقدة على مستوى جزيء واحد، ولكن ما زالت هذه الجسيمات تم العثور لعرض ضعف الانتشار في البيئات المزدحمة مثل الجزيئية السيتوبلازم الخلوي ومتشابك الخلايا العصبية الحلقي، حيث لا تزال أحجامها كبيرة جدا 4،6 ، 7.ونحن مؤخرا المهندسة والنوى والطلاء سطح QDs لحجم مصغر الهيدروديناميكية، في حين تحقيق التوازن بين إزاحة للاستقرار الغروية، صمود للضوء، والسطوع، وملزم غير محددة التي أعاقت فائدة QDs المضغوط في 8،9 الماضية. الهدف من هذه المقالة هو لإثباتتركيب، وتعديل، وتوصيف هذه البلورات النانوية الأمثل، يتكون من قرص مضغوط سبائك الزئبق X 1-X سي الأساسية المغلفة مع الزنك العازلة ذ CD 1-Y قذيفة S، المزيد المغلفة مع يجند البوليمر تعديل متعدد الأسنان مع البولي ايثيلين جلايكول قصيرة ( PEG) سلاسل (الشكل 1). مقارنة مع البلورات النانوية CdSe التقليدية، الزئبق أسطوانة 1-X سبائك سي تتيح قدرا أكبر من عائدات الكم من مضان، مضان في الأطوال الموجية الحمراء وتحت الحمراء القريبة لتعزيز إشارة الضوضاء لفي الخلايا، والإثارة في غير السامة للخلايا موجات مرئية. متعدد الأسنان الطلاء البوليمر ربط سطح النانوية في التشكل مغلقة ومسطحة لتقليل حجم الهيدروديناميكية، وPEG يحيد التهمة سطح ملزمة للحد من غير محدد إلى الخلايا والجزيئات الحيوية. والنتيجة النهائية هي النانوية مع نيون الزاهية الانبعاثات بين 550-800 نانومتر وحجم إجمالي الهيدروديناميكية بالقرب 12 ميل بحري. هذا هو في لياليمجموعة AME حجم والعديد من البروتينات الكروية قابلة للذوبان في الخلايا، وأصغر بكثير من مضاد للفيروسات التقليدية QDs (25-35 نانومتر).
Protocol
Representative Results
Discussion
مقارنة التقليدية نقاط الكم CdSe، يمكن ضبطها الثلاثي سبائك الزئبق أسطوانة 1-X البلورات النانوية سي في الحجم والطول الموجي مضان بشكل مستقل. يتم تحديد حجم أولا خلال تجميع النوى النانوية CdSe، ويتم اختيار الطول الموجي مضان في خطوة الزئبق الثانوية تبادل الأيونات الموجب…
Divulgations
The authors have nothing to disclose.
Acknowledgements
فإن الكتاب أود أن أشكر الدكتور هونغ يي في جامعة إيموري الأساسية المتكاملة للتصوير المجهري المجهر الإلكتروني. وقد رعت هذا العمل من قبل المعاهد الوطنية للصحة منح (PN2EY018244، R01 CA108468، U54CA119338، و1K99CA154006 01-).
Materials
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercaptoethanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer’s Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -. B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. . The Manipulation of Air-Sensitive Compounds. , (1986).
- Errington, R. J. . Advanced Practical Inorganic and Metalorganic Chemistry. , (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).