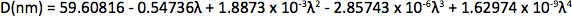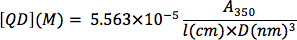Compact Puntos Cuánticos for Imaging sola molécula
Summary
Se describe la preparación de puntos cuánticos coloidales con un tamaño minimizado hidrodinámico para imágenes de fluorescencia de una sola molécula. En comparación con los puntos cuánticos, estas nanopartículas son similares en tamaño a las proteínas globulares y están optimizados para el brillo de una sola molécula, la estabilidad contra la fotodegradación, y la resistencia a la unión no específica a proteínas y células.
Abstract
Una sola molécula de imágenes es una herramienta importante para la comprensión de los mecanismos de la función biomolecular y para la visualización de la heterogeneidad espacial y temporal de los comportamientos moleculares que subyacen a la biología celular 1-4. Para la imagen de una molécula individual de interés, que se conjuga típicamente a una etiqueta fluorescente (tinte, proteína, perla o punto cuántico) y se observaron con epifluorescencia o de reflexión interna total de fluorescencia (TIRF) microscopía. Aunque los tintes y las proteínas fluorescentes han sido el pilar de imágenes de fluorescencia durante décadas, su fluorescencia es inestable bajo altos flujos de fotones necesarios para observar las moléculas individuales, produciendo sólo unos pocos segundos de observación antes de la pérdida completa de la señal. Perlas de látex y perlas marcada con colorante de proporcionar una mayor estabilidad de la señal, pero a expensas de tamaño hidrodinámico drásticamente más grande, que puede alterar perjudicialmente a la difusión y el comportamiento de la molécula en estudio.
ntent "> Los puntos cuánticos (QDs) ofrecen un equilibrio entre estos dos regímenes problemáticos. Estas nanopartículas están compuestas de materiales semiconductores y pueden ser diseñados con un tamaño compacto hidrodinámicamente con una excepcional resistencia a la fotodegradación 5. Por tanto, en años recientes los puntos cuánticos han sido instrumentales en que permite observación a largo plazo del comportamiento complejo macromolecular en el nivel de moléculas individuales. Sin embargo estas partículas han todavía ha encontrado que exhiben deterioro de la difusión en ambientes de hacinamiento molecular, tales como el citoplasma celular y la hendidura sináptica neuronal, donde sus tamaños son todavía demasiado grandes 4,6 , 7.Recientemente hemos diseñado los núcleos y revestimientos de superficies de puntos cuánticos para el tamaño minimizado hidrodinámico, mientras que equilibrar las compensaciones a la estabilidad coloidal, fotoestabilidad, el brillo, y de unión no específicos que han obstaculizado la utilidad de QDs compactos en el pasado 8,9. El objetivo de este artículo es demostrarla síntesis, la modificación, y la caracterización de estos nanocristales optimizados, compuesto de una aleación Cd Hg x 1-x núcleo Se recubierta con un aislante Zn Cd y 1-y shell S, recubierto adicionalmente con un ligando multidentado polímero modificado con polietilenglicol corto ( cadenas PEG) (Figura 1). En comparación con los nanocristales de CdSe convencionales, Hg x CD 1-x aleaciones de Se ofrecen mayores rendimientos cuánticos de fluorescencia, fluorescencia a longitudes de onda roja e infrarroja cercana para una mejor relación señal-ruido en las células, y la excitación a no citotóxicas longitudes de onda visibles. Multidentados revestimientos de polímero se unen a la superficie de nanocristales en una conformación cerrada y plana para minimizar el tamaño hidrodinámico, y PEG neutraliza la carga de la superficie para minimizar la unión no específica a las células y biomoléculas. El resultado final es un brillante fluorescente nanocristales con emisión entre 550-800 nm y un tamaño hidrodinámico total de cerca de 12 nm. Esto es en el sAME intervalo de tamaño como muchas proteínas solubles globulares en células, y sustancialmente más pequeños que los convencionales de puntos cuánticos PEGilados (25-35 nm).
Protocol
Representative Results
Discussion
En comparación con los convencionales CdSe puntos cuánticos, aleación ternaria Hg Cd x 1-x nanocristales de Se puede ajustar en tamaño y longitud de onda de fluorescencia de forma independiente. El tamaño se selecciona por primera vez durante la síntesis de nanocristales de CdSe núcleos, y la longitud de onda de fluorescencia se elige en una etapa de intercambio de cationes secundaria de mercurio, que no altera sustancialmente el tamaño de nanocristales 9. Es importante permitir que el Hg p…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Los autores desean agradecer al Dr. Hong Yi en el Núcleo de la Universidad Emory Microscopía Integrado de imágenes de microscopía electrónica. Este trabajo ha sido patrocinado por el NIH subvenciones (PN2EY018244, R01 CA108468, U54CA119338 y 1K99CA154006-01).
Materials
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercaptoethanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer’s Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -. B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. . The Manipulation of Air-Sensitive Compounds. , (1986).
- Errington, R. J. . Advanced Practical Inorganic and Metalorganic Chemistry. , (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).