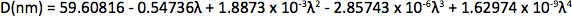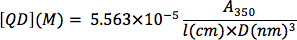Compact Quantum Dots per singola molecola Imaging
Summary
Si descrive la preparazione di punti quantici colloidali con minimizzata dimensione idrodinamica per singola molecola imaging di fluorescenza. Rispetto ai tradizionali punti quantici, queste nanoparticelle sono di dimensioni simili alle proteine globulari e sono ottimizzati per singola molecola luminosità, stabilità contro la fotodegradazione, e resistenza al legame non specifico a proteine e cellule.
Abstract
Singola molecola di imaging è uno strumento importante per la comprensione dei meccanismi di funzionamento biomolecolare e per visualizzare l'eterogeneità spaziale e temporale dei comportamenti molecolari che sono alla base della biologia cellulare 1-4. Esporre una singola molecola di interesse, è tipicamente coniugato ad un tag fluorescente (colorante, proteine, perlina, o quantum dot) e osservato con epifluorescenza o totale riflessione interna fluorescenza (TIRF) microscopio. Mentre coloranti e proteine fluorescenti sono state il pilastro di immagini a fluorescenza per decenni, la loro fluorescenza è instabile in alto fondenti fotoni necessari per osservare singole molecole, ottenendo solo pochi secondi di osservazione prima completa perdita di segnale. Perle di lattice e perline dye-etichettati fornire stabilità del segnale migliorata, ma a scapito della dimensione idrodinamica drasticamente più grande, che può alterare deleteria la diffusione e il comportamento della molecola in esame.
S copi "> Punti quantici (QD) offrono un equilibrio tra questi due regimi problematici. Queste nanoparticelle sono composti da materiali semiconduttori e può essere costruito con un idrodinamico compatto con eccezionale resistenza alla fotodegradazione 5. Così, nel corso degli ultimi anni QD sono state fondamentali per consentire osservazione a lungo termine del comportamento complesso macromolecolare a livello di singola molecola. Tuttavia, queste particelle sono ancora stati trovati esporre diffusione ridotta in ambienti affollati molecolari come il citoplasma cellulare e la fessura sinaptica neuronale, in cui le loro dimensioni sono ancora troppo grandi 4,6 , 7.Recentemente abbiamo progettato i nuclei e rivestimenti per superfici di QD per ridurre al minimo dimensioni idrodinamico, mentre il bilanciamento offset per la stabilità colloidale, fotostabilità, luminosità, e vincolante non specifici che hanno impedito l'utilità di QD compatti in passato 8,9. L'obiettivo di questo articolo è quello di dimostrarela sintesi, la modifica e la caratterizzazione di questi nanocristalli ottimizzate, composto da una lega Hg Cd x 1-x Se nucleo rivestito con un isolante Zn Cd y 1-y shell S, ulteriormente rivestito con un legante polimerico multidentati modificato con polietilenglicole corta ( PEG) catene (Figura 1). Rispetto ai nanocristalli CdSe convenzionali, Hg Cd x 1-x leghe selenio offrire maggiori rese quantiche di fluorescenza, fluorescenza a lunghezze d'onda rosse e nel vicino infrarosso per una maggiore rapporto segnale-rumore nelle cellule, e di eccitazione a lunghezze d'onda visibili non citotossiche. Multidentati rivestimenti polimerici legarsi alla superficie nanocristallo in una conformazione chiusa e piana di minimizzare la dimensione idrodinamica, PEG e neutralizza la carica superficiale per ridurre il legame non specifico di cellule e biomolecole. Il risultato finale è un nanocristallo brillantemente fluorescente con emissione tra 550-800 nm e una dimensione idrodinamica totale vicino a 12 nm. Questo è in same gamma di dimensioni, come molte proteine globulari solubili nelle cellule, e di dimensioni notevolmente inferiori rispetto ai tradizionali QD pegilato (25-35 nm).
Protocol
Representative Results
Discussion
Rispetto ai tradizionali CdSe punti quantici, in lega ternaria Hg Cd x 1-x nanocristalli SE può essere sintonizzato per dimensioni e lunghezza d'onda di fluorescenza in modo indipendente. La dimensione viene prima selezionata durante la sintesi di nanocristalli CdSe nuclei, e la lunghezza d'onda di fluorescenza viene scelto in una fase secondaria di scambio cationico mercurio, che non alteri sostanzialmente le dimensioni nanocristallo 9. È importante permettere purificato Hg Cd x 1-x…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare il Dr. Hong Yi presso la Emory University di Microscopia di base integrata per l'imaging microscopia elettronica. Questo lavoro è stato sponsorizzato dal NIH (PN2EY018244, R01 CA108468, U54CA119338 e 1K99CA154006-01).
Materials
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercaptoethanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer’s Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -. B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. . The Manipulation of Air-Sensitive Compounds. , (1986).
- Errington, R. J. . Advanced Practical Inorganic and Metalorganic Chemistry. , (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).