Grootbrengen en Double-stranded RNA-gemedieerde gen knock-down in het verbergen Kever,<em> Dermestes maculatus</em
Summary
Hier presenteren we protocollen voor het kweken van een intermediair-kiem kever, Dermestes maculatus (D. maculatus) in het lab. We hebben ook protocollen voor de embryonale en ouderlijke RNAi en methodes te delen voor het analyseren van embryonale fenotypes voor bestudering van genfunctie in deze soort.
Abstract
Advances in genomics have raised the possibility of probing biodiversity at an unprecedented scale. However, sequence alone will not be informative without tools to study gene function. The development and sharing of detailed protocols for the establishment of new model systems in laboratories, and for tools to carry out functional studies, is thus crucial for leveraging the power of genomics. Coleoptera (beetles) are the largest clade of insects and occupy virtually all types of habitats on the planet. In addition to providing ideal models for fundamental research, studies of beetles can have impacts on pest control as they are often pests of households, agriculture, and food industries. Detailed protocols for rearing and maintenance of D. maculatus laboratory colonies and for carrying out dsRNA-mediated interference in D. maculatus are presented. Both embryonic and parental RNAi procedures-including apparatus set up, preparation, injection, and post-injection recovery-are described. Methods are also presented for analyzing embryonic phenotypes, including viability, patterning defects in hatched larvae, and cuticle preparations for unhatched larvae. These assays, together with in situ hybridization and immunostaining for molecular markers, make D. maculatus an accessible model system for basic and applied research. They further provide useful information for establishing procedures in other emerging insect model systems.
Introduction
In 1998, Fire en Mello meldde dat dubbelstrengs RNA (dsRNA) remming van genfunctie kan induceren in Caenorhabditis elegans 1. Deze reactie veroorzaakt door dsRNA werd genoemd RNA interferentie (RNAi) en dergelijke RNAi-gemedieerde silencing werd gerapporteerd als zijnde geconserveerd in dieren, planten en schimmels 2-7. In planten en sommige dieren, RNAi functies systemisch, wat betekent dat het effect kan zich verspreiden naar andere cellen / weefsels waarbij dsRNA niet rechtstreeks geïntroduceerd (beoordeeld in 8-10). Wetenschappers hebben gebruik gemaakt van deze endogene cellulaire RNAi respons door het ontwerpen van dsRNA's om genen van belang gericht zijn gemaakt, waardoor de functie van genen neerhalen zonder direct het manipuleren van het genoom (beoordeeld in 11-14).
RNAi is een krachtig hulpmiddel voor functionele studies vanwege de volgende voordelen. Eerst, zelfs met minimale informatie gensequentie, een gen kan worden gevist met RNAi. Dit is vooral belangrijk voor studies van niet-model organismen ontbreekt genomische of transcriptomics data. Ten tweede, in organismen waar RNAi respons robuust systemische RNAi-gemedieerde gen knockdown kan worden uitgevoerd op bijna elk ontwikkelingsstadium. Deze functie is zeer nuttig voor het bestuderen van de functie van pleiotrope genen. Ten derde, in sommige gevallen, RNAi effecten uitbreiden tot de gonaden en nageslacht, zodat fenotypes worden waargenomen bij nakomelingen 15,16. Dit fenomeen, bekend als ouderlijke RNAi (pRNAi), is bijzonder voordelig voor genen beïnvloeden embryonale ontwikkeling, talrijke nakomelingen van één ouder geïnjecteerd zonder directe manipulatie eieren kunnen worden onderzocht. Daarom pRNAi is de voorkeurswerkwijze. Indien pRNAi ineffectief, bijvoorbeeld voor genen die nodig zijn voor oogenesis, dan embryonale RNAi (eRNAi) worden gebruikt. Ten vierde kan RNAi worden gebruikt om het equivalent van een allelische reeks, dat de hoeveelheid dsRNA geleverd over een bereik kan worden gevarieerd wekken zwakke produceren sterke gebreken. Dergelijke gradatie van fenotypes kan nuttig zijn voor het begrijpen van genfunctie wanneer het gen is betrokken bij een complex proces en / of volledig verlies van functie dodelijk. Ten vijfde, de levering van dsRNA is over het algemeen gemakkelijk en haalbaar is, met name in dieren die robuuste systemische RNAi reacties. dsRNA kan worden ingevoerd door micro-injectie 1,5, het voeden / inname 17,18, weken, 19,20 en virus / bacteriën gemedieerde aflevering 21,22. Zesde, in tegenstelling tot sommige gentargeting / bewerken werkwijzen hoeft te screenen op organismen die de mutatie of genetische kruisingen aan homozygoten genereren bij gebruik RNAi uitvoeren. Daarom in vergelijking met vele andere technieken voor het bestuderen van genfunctie, RNAi is snel, goedkoop en kunnen worden toegepast voor grootschalige schermen 23-25.
De brede toepasbaarheid van RNAi verschaft middelen functionele studies uit te voeren in een breed scala van organismen, het uitbreiden van het bereik van de soorten beschikbaar voor studie beyond de traditionele modelsystemen waarvoor genetische instrumenten ontwikkeld. Bijvoorbeeld, studies met niet-modelsystemen vereist om inzicht in de evolutie van genen en gen netwerken geven door vergelijking van de functies van orthologen voor soorten van verschillende modes of ontwikkeling vertonen duidelijke morfologische kenmerken 26-29. Deze types van studies zullen een beter begrip van de biologische diversiteit te voorzien, met gevolgen voor zowel toegepast en fundamenteel onderzoek.
Omdat het grootste dier groep op de planeet, insecten zorgen voor een geweldige kans om de mechanismen te onderzoeken onderliggende diversiteit. Bovendien, insecten zijn over het algemeen klein, hebben korte levenscycli, hoge vruchtbaarheid, en zijn eenvoudig aan de achterzijde in het lab. In de afgelopen twee decennia, is RNAi is met succes toegepast bij insecten verspreid over orders, met inbegrip van Diptera (true vliegen) 5, Lepidoptera (vlinders en motten) 30, Coleoptera (kevers) 16,31, Hymenoptera (sawfleugens, wespen, mieren en bijen) 32, Hemiptera (wantsen), Isoptera (termieten) 34, Blattodea (kakkerlakken) 35, Orthoptera (krekels, sprinkhanen, sprinkhanen, en katydids) 36 en Phthiraptera (luizen) 37. Succesvolle toepassing van RNAi heeft verstrekt functionele gegevens voor onderzoek naar patronen in de vroege embryogenese (anterior-posterior as 32, dorsale-ventrale as 28, segmentatie 26,38), geslachtsbepaling 39,40, chitine / cuticula biosynthese 41, ecdyson signalering 42, sociaal gedrag 43, en nog veel meer. RNAi methoden ontwikkeld voor verschillende insectensoorten kunnen bijkomende voordeel dat zij mogelijk bruikbaar voor ongediertebestrijding (herzien 44-46) te zijn. RNAi effecten genspecifieke en soortspecifiek zijn, zolang als niet-geconserveerde gebieden worden gekozen voor targeting. Voor nuttige insecten zoals bijen en zijderupsen, gericht op genen die van vitaal belang voor het voortbestaan vanvirussen of parasieten om besmetting te bestrijden kan een nieuwe strategie om deze soorten te beschermen 47,48 bieden.
Dermestes Maculatus (D. maculatus), gangbare naam hide kever, wordt wereldwijd verspreid, met uitzondering van Antarctica. Als holometabolous insect, de D. maculatus levenscyclus omvat embryonale, larven, pupal en volwassen stadia (figuur 1). Omdat het voedt zich met vlees, wordt D. maculatus gebruikt in musea dode dieren schets maken en forensische entomologen kunt het gebruiken om het tijdstip van overlijden 49,50 te schatten. D. maculatus zich voedt met dierlijke producten zoals kadavers, gedroogd vlees, kaas, en de poppen / cocons van andere insecten en veroorzaakt daarmee schade aan huishoudens, opgeslagen voedsel, en de zijde, kaas en vlees-industrie 51,52. Het toepassen van RNAi in deze kever zou een efficiënte en milieuvriendelijke manier om de economische gevolgen te minimaliseren. Ons laboratorium heeft gebruikt D. maculatus als een nieuwe model insect segmentering 53 bestuderen. Naast het feit dat vatbaar lab fokken, D. maculatus van belang voor fundamenteel onderzoek omdat het een tussenproduct kiem ontwikkelaar, waardoor het een nuttige soorten naar de overgang tussen korte en lange kiem ontwikkeling bestuderen.
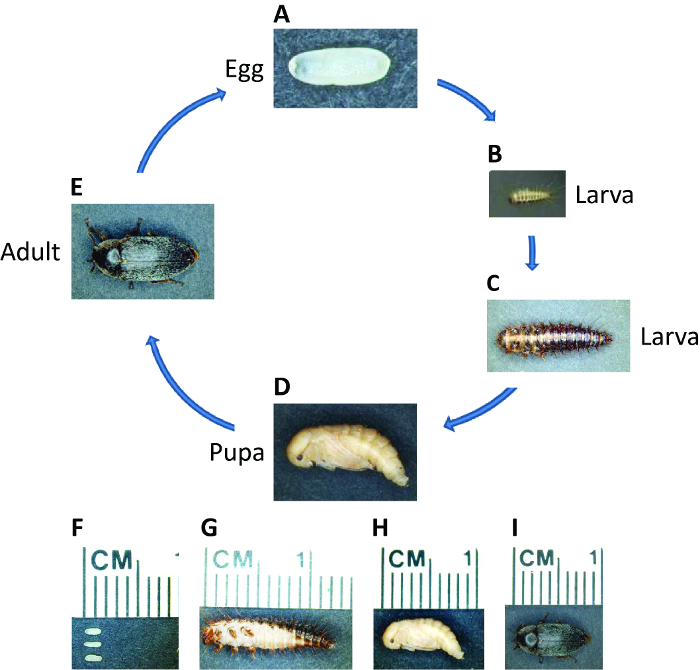
Figuur 1: Life Cycle van D. maculatus. Foto's van D. maculatus in verschillende levensfasen, zoals aangegeven. De levenscyclus van ei tot adult bedraagt drie weken bij 30 ° C, maar meer bij lagere temperaturen. (A, F) Vers gelegd embryo's zijn wit tot lichtgeel en ovaal, ongeveer 1,5 mm in lengte. Embryogenese draait ~ 55 uur bij 30 ° C. (B, C en G) Larven hebben donkere gepigmenteerde strepen en zijn bedekt met borstels. Larven gaan door verschillende stadia, afhankelijk van de omgeving en hun lengte kan zich uitstrekken tot meer dan 1 cm. (D, H) </strong> Young poppen zijn lichtgeel. Verpopping vindt ~ 5-7 dagen bij 30 ° C. (E, I) Kort na eclosion, verschijnt donkere pigmentvlekken op de volwassen kever lichaam. Volwassenen kunnen leven tot enkele maanden en een vrouwtje kan honderden embryo's lag over haar leven. Klik hier om een grotere versie van deze figuur te bekijken.
Eerder toonden we aan dat RNAi is effectief in het neerhalen gen-functie in D. maculatus 53. Hier onze ervaring fokken D. maculatus kolonies in het laboratorium wordt gedeeld met stap-voor-stap protocollen voor zowel embryonale en ouderlijke RNAi set-up, injectie, na de injectie zorg en fenotypische analyse. De dsRNA-gemedieerde gen knockdown en analysemethoden hier geïntroduceerd bieden niet alleen gedetailleerde informatie voor de aanpak van vraagstukken in D. maculatus, maar ook potentiële betekenis for toepassing van RNAi in andere niet-model kever / insectensoorten.
Protocol
Representative Results
Discussion
Terwijl een klein aantal geavanceerde modelsystemen (muizen, vliegen, wormen) werden ontwikkeld tijdens de 20 e eeuw, heeft de 21e eeuw gezien een golf van nieuwe dierlijke systemen worden ontwikkeld in laboratoria over de hele wereld. Deze nieuwe systemen kunnen wetenschappers vergelijkende, evolutionaire vragen die niet kunnen worden gesondeerd met behulp van alleen de 'standaard' modelsystemen te pakken. Deze implementatie van nieuwe modellen vereist de snelle ontwikkeling van methoden v…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We thank Drs. Alison Heffer and Yong Lu for setting up the microinjection apparatus and sharing their invaluable knowledge and experience with insect RNAi. This work was supported by the National Institutes of Health (R01GM113230 to L.P.).
Materials
| Dermestes maculatus live beetles | Our lab or Carolina Biological Supply | #144168 | Our lab strain was verified by COI barcoding; strain variation from Carolina cannot be ruled out |
| Wet cat food | Fancy Feast | Chunks of meat with gravy. Can buy at most pet food and grocery stores | |
| Dry dog food | Purina Puppy Chow | Can buy at most pet food and grocery stores | |
| Insect cage (size medium, 30.5x19x20.3 cm) | Exo Terra | PT2260 | For colony maintenance. Can use larger cage if needed |
| Insect cage (size mini, 17.8×10.2×12.7 cm) | Exo Terra | PT2250 | For embryo collection |
| Petri dish | VWR | 89038-968 | |
| Cotton ball | Fisher | 22-456-883 | |
| Megascript T7 transcription kit | Fisher | AM1334 | For 40 reactions |
| Pneumatic pump | WPI | PV830 | |
| Capillary holder | WPI | ||
| Micromanipulator | NARISHIGE | MN-151 | |
| Black filter paper (90 mm) | VWR | 28342-010 | |
| Food coloring (green) | McCormick | ||
| Borosilicate glass capillary | Hilgenberg | 1406119 | |
| Needle puller (micropipette puller) | Sutter Instrument Co. | P-97 | |
| Microscope glass slide | WorldWide Life Sciences Division | 41351157 | |
| Sealing film (Parafilm M) | Fisher | 13-374-12 | |
| Model 801 Syringe (10 µl ) | Hamilton | 7642-01 | |
| Needle (32-gauge) | Hamilton | 7762-05 | |
| Fixation Solution (Pampel's) | BioQuip Products, Inc. | 1184C | Toxic, needs to be handled in fume hood |
| Forcep (DUMONT #5) | Fine Science Tools | 11252-30 | |
| Cover slip (24X50 mm, No. 1.5) | Globe Scientific | 1415-15 | |
| Eppendorf Femtotips Microloader pipette tip | Fisher | E5242956003 | |
| Dissecting microscopy for embryo injection | Leica | M420 | |
| Dissecting microscopy for larval phenotypic visualization | Zeiss | SteREO Discover. V12 | |
| DIC microscopy | Zeiss | AXIO Imager. M1 | |
References
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. 2, 70-75 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127, 4147-4156 (2000).
- Zimmermann, T. S., et al. RNAi-mediated gene silencing in non-human primates. Nature. 441, 111-114 (2006).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95, 1017-1026 (1998).
- Cogoni, C., et al. Transgene silencing of the al-1 gene in vegetative cells of Neurospora is mediated by a cytoplasmic effector and does not depend on DNA-DNA interactions or DNA methylation. EMBO J. 15, 3153-3163 (1996).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. Plant Cell. 2, 279-289 (1990).
- van Roessel, P., Brand, A. H. Spreading silence with Sid. Genome Biol. 5, 208 (2004).
- Grishok, A. RNAi mechanisms in Caenorhabditis elegans. FEBS Lett. 579, 5932-5939 (2005).
- Jose, A. M., Hunter, C. P. Transport of sequence-specific RNA interference information between cells. Annu Rev Genet. 41, 305-330 (2007).
- Hannon, G. J. RNA interference. Nature. 418, 244-251 (2002).
- Hammond, S. M., Caudy, A. A., Hannon, G. J. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet. 2, 110-119 (2001).
- Dorsett, Y., Tuschl, T. siRNAs: applications in functional genomics and potential as therapeutics. Nat Rev Drug Discov. 3, 318-329 (2004).
- Agrawal, N., et al. RNA interference: biology, mechanism, and applications. Microbiol Mol Biol Rev. 67, 657-685 (2003).
- Grishok, A., Tabara, H., Mello, C. C. Genetic requirements for inheritance of RNAi in C. elegans. Science. 287, 2494-2497 (2000).
- Bucher, G., Scholten, J., Klingler, M. Parental RNAi in Tribolium (Coleoptera). Curr Biol. 12, 85-86 (2002).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854 (1998).
- Turner, C. T., et al. RNA interference in the light brown apple moth, Epiphyas postvittana (Walker) induced by double-stranded RNA feeding. Insect Mol Biol. 15, 383-391 (2006).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: soaking in the genome sequence. Science. 282, 430-431 (1998).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Travanty, E. A., et al. Using RNA interference to develop dengue virus resistance in genetically modified Aedes aegypti. Insect Biochem Mol Biol. 34, 607-613 (2004).
- Whitten, M. M., et al. Symbiont-mediated RNA interference in insects. Proc Biol Sci. 283, (2016).
- Schmitt-Engel, C., et al. The iBeetle large-scale RNAi screen reveals gene functions for insect development and physiology. Nat Commun. 6, 7822 (2015).
- Dönitz, J., et al. iBeetle-Base: a database for RNAi phenotypes in the red flour beetle Tribolium castaneum. Nucleic Acids Res. 43, 720-725 (2015).
- Ulrich, J., et al. Large scale RNAi screen in Tribolium reveals novel target genes for pest control and the proteasome as prime target. BMC Genomics. 16, 674 (2015).
- Choe, C. P., Miller, S. C., Brown, S. J. A pair-rule gene circuit defines segments sequentially in the short-germ insect Tribolium castaneum. Proc. Natl. Acad. Sci. U. S. A. 103, 6560-6564 (2006).
- Angelini, D. R., Kaufman, T. C. Functional analyses in the hemipteran Oncopeltus fasciatus reveal conserved and derived aspects of appendage patterning in insects. Dev Biol. 271, 306-321 (2004).
- Lynch, J. A., Peel, A. D., Drechsler, A., Averof, M., Roth, S. EGF signaling and the origin of axial polarity among the insects. Curr Biol. 20, 1042-1047 (2010).
- Tenlen, J. R., McCaskill, S., Goldstein, B. RNA interference can be used to disrupt gene function in tardigrades. Dev Genes Evol. 223, 171-181 (2013).
- Quan, G. X., Kanda, T., Tamura, T. Induction of the white egg 3 mutant phenotype by injection of the double-stranded RNA of the silkworm white gene. Insect Mol Biol. 11, 217-222 (2002).
- Brown, S. J., Mahaffey, J. P., Lorenzen, M. D., Denell, R. E., Mahaffey, J. W. Using RNAi to investigate orthologous homeotic gene function during development of distantly related insects. Evol Dev. 1, 11-15 (1999).
- Lynch, J. A., Brent, A. E., Leaf, D. S., Pultz, M. A., Desplan, C. Localized maternal orthodenticle patterns anterior and posterior in the long germ wasp Nasonia. Nature. 439, 728-732 (2006).
- Liu, P. Z., Kaufman, T. C. hunchback is required for suppression of abdominal identity, and for proper germband growth and segmentation in the intermediate germband insect Oncopeltus fasciatus. Development. 131, 1515-1527 (2004).
- Zhou, X., Wheeler, M. M., Oi, F. M., Scharf, M. E. RNA interference in the termite Reticulitermes flavipes through ingestion of double-stranded RNA. Insect Biochem Mol Biol. 38, 805-815 (2008).
- Ciudad, L., Piulachs, M. D., Bellés, X. Systemic RNAi of the cockroach vitellogenin receptor results in a phenotype similar to that of the Drosophila yolkless mutant. FEBS J. 273, 325-335 (2006).
- Mito, T., et al. Non-canonical functions of hunchback in segment patterning of the intermediate germ cricket Gryllus bimaculatus. Development. 132, 2069-2079 (2005).
- Yoon, K. S., et al. Brief exposures of human body lice to sublethal amounts of ivermectin over-transcribes detoxification genes involved in tolerance. Insect Mol Biol. 20, 687-699 (2011).
- Rosenberg, M. I., Brent, A. E., Payre, F., Desplan, C. Dual mode of embryonic development is highlighted by expression and function of Nasonia pair-rule genes. Elife. 3, 01440 (2014).
- Hasselmann, M., et al. Evidence for the evolutionary nascence of a novel sex determination pathway in honeybees. Nature. 454, 519-522 (2008).
- Shukla, J. N., Palli, S. R. Sex determination in beetles: production of all male progeny by parental RNAi knockdown of transformer. Sci Rep. 2, 602 (2012).
- Arakane, Y., et al. The Tribolium chitin synthase genes TcCHS1 and TcCHS2 are specialized for synthesis of epidermal cuticle and midgut peritrophic matrix. Insect Mol Biol. 14, 453-463 (2005).
- Cruz, J., Mané-Padròs, D., Bellés, X., Martìn, D. Functions of the ecdysone receptor isoform-A in the hemimetabolous insect Blattella germanica revealed by systemic RNAi in vivo. Dev Biol. 297, 158-171 (2006).
- Guidugli, K. R., et al. Vitellogenin regulates hormonal dynamics in the worker caste of a eusocial insect. FEBS Lett. 579, 4961-4965 (2005).
- Zhang, H., Li, H. C., Miao, X. X. Feasibility, limitation and possible solutions of RNAi-based technology for insect pest control. Insect Sci. 20, 15-30 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: a review. J Insect Physiol. 56, 227-235 (2010).
- Price, D. R., Gatehouse, J. A. RNAi-mediated crop protection against insects. Trends Biotechnol. 26, 393-400 (2008).
- Paldi, N., et al. Effective gene silencing in a microsporidian parasite associated with honeybee (Apis mellifera) colony declines. Appl Environ Microbiol. 76, 5960-5964 (2010).
- Kanginakudru, S., et al. Targeting ie-1 gene by RNAi induces baculoviral resistance in lepidopteran cell lines and in transgenic silkworms. Insect Mol Biol. 16, 635-644 (2007).
- Magni, P. A., Voss, S. C., Testi, R., Borrini, M., Dadour, I. R. A Biological and Procedural Review of Forensically Significant Dermestes Species (Coleoptera: Dermestidae). J Med Entomol. 52, 755-769 (2015).
- Zanetti, N. I., Visciarelli, E. C., Centeno, N. D. The Effect of Temperature and Laboratory Rearing Conditions on the Development of Dermestes maculatus (Coleoptera: Dermestidae). J Forensic Sci. , (2015).
- Veer, V., Negi, B. K., Rao, K. M. Dermestid beetles and some other insect pests associated with stored silkworm cocoons in India, including a world list of dermestid species found attacking this commodity. Journal of Stored Products Research. 32, 69-89 (1996).
- Xiang, J., Forrest, I. S., Pick, L. Dermestes maculatus: an intermediate-germ beetle model system for evo-devo. Evodevo. 6, 32 (2015).
- Fontenot, E. A., Arthur, F. H., Hartzer, K. L. Oviposition of Dermestes maculatus DeGeer, the hide beetle, as affected by biological and environmental conditions. Journal of Stored Products Research. 64, 154-159 (2015).
- Heffer, A., Grubbs, N., Mahaffey, J., Pick, L. The evolving role of the orphan nuclear receptor ftz-f1, a pair-rule segmentation gene. Evol Dev. 15, 406-417 (2013).
- Heffer, A., Shultz, J. W., Pick, L. Surprising flexibility in a conserved Hox transcription factor over 550 million years of evolution. Proc. Natl. Acad. Sci. U. S. A. 107, 18040-18045 (2010).
- Wilson, M. J., Dearden, P. K. Pair-rule gene orthologues have unexpected maternal roles in the honeybee (Apis mellifera). PLoS One. 7, 46490 (2012).
- Dawes, R., Dawson, I., Falciani, F., Tear, G., Akam, M. Dax, a locust Hox gene related to fushi-tarazu but showing no pair-rule expression. Development. 120, 1561-1572 (1994).
- Erezyilmaz, D. F., Kelstrup, H. C., Riddiford, L. M. The nuclear receptor E75A has a novel pair-rule-like function in patterning the milkweed bug, Oncopeltus fasciatus. Dev Biol. 334, 300-310 (2009).
- Stuart, J. J., Brown, S. J., Beeman, R. W., Denell, R. E. A deficiency of the homeotic complex of the beetle Tribolium. Nature. 350, 72-74 (1991).
- Aranda, M., Marques-Souza, H., Bayer, T., Tautz, D. The role of the segmentation gene hairy in Tribolium. Dev Genes Evol. 218, 465-477 (2008).
- Mito, T., et al. even-skipped has gap-like, pair-rule-like, and segmental functions in the cricket Gryllus bimaculatus, a basal, intermediate germ insect (Orthoptera). Dev Biol. 303, 202-213 (2007).
- Patel, N. H., Ball, E. E., Goodman, C. S. Changing role of even-skipped during the evolution of insect pattern formation. Nature. 357, 339-342 (1992).
- Nüsslein-Volhard, C., Wieschaus, E. Mutations affecting segment number and polarity in Drosophila. Nature. 287, 795-801 (1980).
- Jürgens, G., Wieschaus, E., Nüsslein-Volhard, C., Kluding, H. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster. II. Zygotic loci on the third chromosome. Wilhelm Roux’s archives of developmental biology. 193, 283-295 (1984).
- Wakimoto, B. T., Kaufman, T. C. Analysis of larval segmentation in lethal genotypes associated with the Aantennapedia gene complex in Drosophila melanogaster. Dev. Biol. 81, 51-64 (1981).
- Yu, Y., et al. The nuclear hormone receptor Ftz-F1 is a cofactor for the Drosophila homeodomain protein Ftz. Nature. 385, 552-555 (1997).
- Nüsslein-Volhard, C., Wieschaus, E., Kluding, H. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster. I.Zygotic loci on the second chromosome. Wilhelm Roux’s archives of developmental biology. 193, 267-282 (1984).
- Wieschaus, E., Nüsslein-Volhard, C., Jürgens, G. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster. III.Zygotic loci on the X-chromosome and fourth chromosome. ‘Wilhelm Roux’s archives of developmental biology. 193, 296-307 (1984).
- Guichet, A., et al. The nuclear receptor homologue Ftz-F1 and the homeodomain protein Ftz are mutually dependent cofactors. Nature. 385, 548-552 (1997).
- Fontenot, E. A., Arthur, F. H., Hartzer, K. L. Effect of diet and refugia on development of Dermestes maculatus DeGeer reared in a laboratory. J Pest Sci. 88, 113-119 (2014).
- Yang, Y., et al. Biodegradation and Mineralization of Polystyrene by Plastic-Eating Mealworms: Part 1. Chemical and Physical Characterization and Isotopic Tests. Environ Sci Technol. 49, 12080-12086 (2015).
- Kitzmann, P., Schwirz, J., Schmitt-Engel, C., Bucher, G. RNAi phenotypes are influenced by the genetic background of the injected strain. BMC Genomics. 14, 5 (2013).
- Chandler, C. H., Chari, S., Tack, D., Dworkin, I. Causes and consequences of genetic background effects illuminated by integrative genomic analysis. Génétique. 196, 1321-1336 (2014).
- Montagutelli, X. Effect of the genetic background on the phenotype of mouse mutations. J Am Soc Nephrol. 11, 101-105 (2000).
- Doetschman, T. Influence of genetic background on genetically engineered mouse phenotypes. Methods Mol Biol. 530, 423-433 (2009).

