Summary
Kutane tumorer kasseres ofte efter Mohs mikrografisk kirurgi. Der beskrives en protokol her, der gør det muligt for klinisk supportpersonale effektivt at behandle og lagre kutan tumor ( fx pladecellekarcinom, basalcellekarcinom og melanom) prøver til downstream-laboratorieapplikationer uden at forstyrre kliniske operationer.
Abstract
Forekomsten af hudkræft ( fx pladecellekarcinom, basalcellecarcinom og melanom) har været stigende i løbet af de seneste år. Det forventes, at der vil være en parallel efterspørgsel efter kutane tumorprøver til biomedicinske undersøgelser. Tilgængelighed af væv er imidlertid begrænset på grund af omkostningerne ved etablering af et biorepository og manglen på protokoller til rådighed for opnåelse af kliniske prøver, der ikke forstyrrer kliniske operationer. En protokol blev oprettet for at indsamle og behandle kutan tumor og tilhørende blod- og spytprøver, der har minimal indflydelse på rutinemæssige kliniske procedurer på datoen for en Mohs-kirurgi. Tumorprøver opsamles og behandles fra patienter, der gennemgår deres første lag af Mohs-kirurgi for biopsi-bevist kutan malignitet hos Mohs-histoteknologen. Tilstødende normalt væv opsamles på tidspunktet for kirurgisk lukning. Yderligere prøver, der kan indsamles, er helblod og buccal swabs. Ved at udnytte vævsprøver, der normalt kasseres, blev der dannet et biorepository, der giver flere vigtige fordele ved at være baseret i klinikken versus laboratorieindstillingen. Disse omfatter en bred vifte af indsamlede prøver; Adgang til deidentificerede patientjournaler, herunder patologirapporter; Og for den typiske donor adgang til yderligere prøver under opfølgende besøg.
Introduction
Kræft- og biomarkørforskning er afhængig af en levering af humane vævsprøver af høj kvalitet, og begrænset forsyning har forhindret forskning 1 , 2 . Mange dermatologiske undersøgelser er begrænset af utilstrækkelig forsyning, variabel kvalitet og omkostninger forbundet med brugen af humant væv. Omkostningerne til at etablere en stor dedikeret biobank er anslået til at være ca. 2 millioner dollars 3 , og disse omkostninger sætter brugen af humant væv utilgængeligt for mange forskere. Desuden udgør processen med generering og opbevaring af undersøgelsesprøver risikoen for at påvirke kliniske operationer og forsinke patientpleje, hvis den ikke udføres forsigtigt. En omkostningseffektiv klinikbaseret biorepository er blevet etableret, der fokuserer på hudkræftprøver efter anbefalede bedste praksis og prøvevalidering 4 , 5 , 6 .
<pClass = "jove_content"> Denne protokol er udviklet i en dermatologi klinik, der udfører et stort antal Mohs mikrografiske operationer for at fjerne pladecellercarcinom (SCC), basalcellecarcinom (BCC) og melanom hudkræft. Frivillige donorer kan rekrutteres fra denne patientpopulation. Det er vigtigt at etablere biorepository på indsamlingsstedet for hurtigt at indfange væv og blod fra samtykke patienter uden forsinket behandling. Indsamling af prøver fra samme klinik minimerer variationer i indsamlingsteknikker og minimerer variationer i kvaliteten af prøver, hvilket kan være problematisk for downstream applikationer 7 , 8 .Målet med Mohs mikrografiske kirurgi teknikken er at sikre, at alt kræftvæv fjernes, samtidig med at der sikres så meget sundt væv. Proceduren involverer progressiv fjernelse af tynde lag af tumorvæv. Hvert efterfølgende lag er hansTologisk undersøgt (efter kryosektion af tumorvævet og udførelse af H & E-farvning) af en hudlæge for at bestemme, om alt kræftvæv er blevet fjernet. Excisionen og undersøgelsen af efterfølgende lag af væv udføres mens patienten forbliver på kontoret. Denne teknik anses for at være den bedste behandlingsmulighed for SCC 9 . På dette tidspunkt er såret lukket og for at forbedre helbredelse og kosmetisk udseende udskæres nærliggende normalt væv (ANT) ofte. Således er denne kirurgiske procedure til fjernelse af en tumor ideel til indsamling af histologisk kendetegnet væv til fremtidige studier.
Indkøbsproceduren for at opnå tumorvæv, der støder op til normalt væv, spyt og blodprøver, er designet til at få minimal indflydelse på normale personaleopgaver ( figur 1 ). Medicinske assistenter udfører blodet, mens patienten forberedes til proceduren. Efter afslutningen af Mohs-proceduren er M Ohs histoteknologen forbereder yderligere histologiske dias af prøven og overfører vævet til biorepositoryet. Omkostninger forbundet med etablering af biorepository omfatter køb af cryopreservation-frysere, oprettelse af beskedent klinisk laboratorierum og udvikling af et opsporingssporingsprogram.
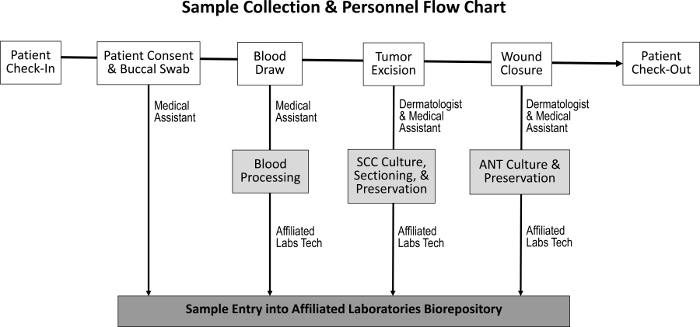
Figur 1: Sekvens af prøveopsamling og ansvarlig personale. Ved patientindcheckning og opnåelse af patientens samtykke indsamler den lægeassistent en buccal swab og udfører en blodtegning. Dermatologen og medicinsk assistent beskytter derefter tumoren og lukker såret, i hvilket tidsrum SCC og ANT prøver opsamles. En dedikeret laboratorie tekniker behandler blodet og sektioner SCC og ANT prøverne til vævskultur, bevaring og indgang i biorepository.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Venligst klik her for at se en større version af denne figur.
Mangfoldigheden af de indsamlede prøver muliggør en række eksperimentelle tilgange ( figur 2 ). Prøver indsamlet fra patienten er buccale swabs (spyt kan også opsamles om nødvendigt), helblod og udskåret væv. Buccal swabs og en prøve fra hele blodet er gemt, uden behandling, til genotyping og vævsafstemning. Hele blod separeres i hvide blodlegemer (WBC) og plasmafraktioner til fremtidige analyser. Efter Mohs-forarbejdning placeres den frosne tumor direkte i flydende nitrogen og overføres til en -80 ° C fryser. Friske, levedygtige tumorvæv og ANT-prøver dyrkes under anvendelse af modifikationer af tidligere teknikker 10 , 11 og derefter kryopreserveret. Under indsamlingen registreres antallet af hver prøvetype på et regneark inden indgangen til Opsporingssporingsprogrammet for at lette nøjagtig behandling ( tabel 1 ).
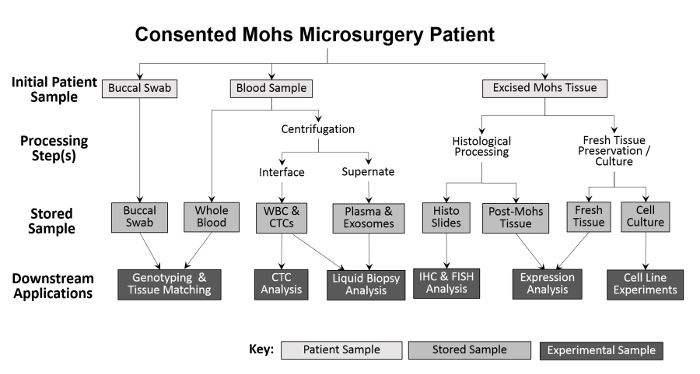
Figur 2: Oversigt over klinikbaseret biorepositoryprøveindsamling og -behandling. En buccal vatpind og blodprøve opsamles fra patienten og opbevares til downstream genotyping og vævsafstemning. Hele blod behandles yderligere til isolering af hvide blodlegemer og CTC-analyser samt for plasmaindsamling og væskebiopsianalyse. Væv udskåret under Mohs-proceduren behandles histologisk til diagnostiske formål, hvorefter de histologiske lysbilleder kan anvendes eksperimentelt til yderligere immunhistokemiske analyser. Forudsat at den udskårne vævsprøve er stor nok, fjernes en del af frisk væv og snittes for protein- og RNA-isolering og til etablering af dyrkede cellelinjer.55583 / 55583fig1large.jpg "target =" _ blank "> Venligst klik her for at se en større version af denne figur.
| Indsamlingsdato: | |||||
| Patient 1 | Patient 2 | Patient 3 | Patient 4 | Patient 5 | |
| Initialer og fødselsdato | |||||
| Øjenfarve | |||||
| Prøvetype | |||||
| Prøveplacering | |||||
| Spyt | |||||
| WHul blod | |||||
| Plasma | |||||
| Tumor levedygtig | |||||
| Tissue Normal Viable | |||||
| Tumor Mohs Flydende Kvælstof | |||||
| Tissue Normal Flydende Kvælstof | |||||
| Slides |
Tabel 1: Tjekliste for at optage stikprøver. Data, der spores og registreres med hver indsamlet prøve, omfatter patientens initialer, fødselsdato og øjenfarve (til hudtyping) samt lokaliseringenPå prøveudtagning. Antallet af spytprøver, blodopsamlingsvolumener og antallet af levende og konserverede vævsprøver indsamles registreres også som referencer for tildelinger til senere anvendelser. Klik her for at downloade denne fil.
For at validere prøveopsamlingsprocedurer er hver prøvetype testet i downstream applikationer. Ved anvendelse af modifikationer af tidligere teknikker 12 er tumor og ANT blevet anvendt med succes i protein- og RNA-isolering og kan potentielt anvendes til DNA-isolering. Levende eksplanter, der er etableret fra vævssektionerne, er blevet evalueret ved mikroskopi, mens lagrede histologiske lysbilleder er blevet anvendt til immunhistokemi og immunofluorescens.
Ved at følge den her beskrevne protokol er det muligt at udvide denne model til andre dermatologiklinikker, andre tumortyper (såsom melanom), Og andre kirurgiske specialiteter og praksis til at tilvejebringe humane vævsprøver til mangesidig forskning i humane kræftformer. Små modifikationer af denne protokol er sandsynligvis nødvendige for andre former for praksis, men i princippet gælder denne protokol for enhver kirurgisk praksis, der rutinemæssigt kasserer patientprøver indsamlet under patientbehandling.
Protocol
Representative Results
Discussion
Efter forfatterens viden er denne protokol den første af sin art, der fokuserer på klinisk indkøb af kutane vævsprøver i både en omkostningseffektiv og hurtig tilgang. Patienter, der undergår Mohs-mikrokirurgi, er typisk planlagt i bestemte tidsblokke, og indsamling er begrænset til disse perioder. Prøveudtagning indebærer indsats fra den medicinske assistent, der er involveret i patientpleje, Mohs histoteknologen, der behandler tumorprøverne og en udpeget laboratoriemedlem, der håndterer prøveindgang og bl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af midler fra Midwestern University College of Health Sciences Research Facilitation Grant, tildelt EEH, og Midwestern University Office of Research og sponsorerede programmer Intramural Grant, tildelt til KJL. Yderligere støtte blev ydet af tilknyttede laboratorier og tilknyttet dermatologi. Vi takker Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel og Ali Zaidi for deres tekniske assistance.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

