Создание клиники на основе биоресурсов
Summary
Кожные опухоли часто отбрасываются после микрографической хирургии Мооса. Здесь описывается протокол, который позволяет персоналу клинической поддержки эффективно обрабатывать и хранить образцы кожного новообразования ( например, плоскоклеточный рак, базально-клеточный рак и меланома) для последующих лабораторных исследований без вмешательства в клинические операции.
Abstract
За последние несколько лет заболеваемость раком кожи ( например, плоскоклеточный рак, базально-клеточная карцинома и меланома) увеличивается. Ожидается, что параллельно будет спрос на образцы кожного новообразования для биомедицинских исследований. Однако доступность тканей ограничена из-за стоимости создания биоресурсов и отсутствия протоколов, доступных для получения клинических образцов, которые не влияют на клинические операции. Был установлен протокол для сбора и обработки кожных опухолей и связанных с ними проб крови и слюны, которые оказывают минимальное влияние на обычные клинические процедуры в день операции Мооса. Образцы опухолей собираются и обрабатываются у пациентов, перенесших первый слой хирургической операции Мооса для биопсии, подтвержденной кожными злокачественными новообразованиями гистонолога Мооса. Прилегающая нормальная ткань собирается во время хирургического закрытия. Дополнительные образцы, которые могут быть собраны, – цельная кровь и щечные тампоны, Используя образцы ткани, которые обычно отбрасываются, был создан биоресурс, который предлагает несколько ключевых преимуществ, основываясь на клинике и лабораторных условиях. Они включают в себя широкий спектр собранных образцов; Доступ к дефинированным записям пациентов, включая отчеты о патологии; И для типичного донора – доступ к дополнительным выборкам во время последующих визитов.
Introduction
Исследования рака и биомаркеров основаны на поставке качественных образцов тканей человека, а ограниченное предложение затрудняет исследования 1 , 2 . Многие дерматологические исследования ограничены недостаточным предложением, изменчивым качеством и затратами, связанными с использованием тканей человека. Стоимость создания крупного специализированного биобанка оценивается примерно в 2 миллиона долларов 3 , и эти затраты ставят использование человеческих тканей недоступным для многих исследователей. Кроме того, процесс создания и хранения исследовательских образцов создает риск влияния на клинические операции и откладывание ухода за пациентом, если его не выполнить тщательно. Создан рентабельный, основанный на клиниках биоресурс, который фокусируется на образцах рака кожи, следуя рекомендуемым передовым методам и валидации образцов 4 , 5 , 6 .
<pЭтот протокол был разработан в дерматологической клинике, которая выполняет большой объем микроскопических операций Мооса для удаления плоскоклеточного рака (ККЦ), базально-клеточной карциномы (BCC) и рака кожи меланомы. Добровольные доноры могут быть набраны из этой популяции пациентов. Важно создать биоресурсор в месте сбора, чтобы быстро захватить ткань и кровь у пациентов, которым было разрешено лечение, без задержки лечения. Сбор проб из одной и той же клиники сводит к минимуму различия в методах сбора и минимизирует различия в качестве образцов, что может быть проблематичным для последующих приложений 7 , 8 .Цель техники микрографической хирургии Мооса заключается в том, чтобы удалить всю раковую ткань, сохраняя при этом как можно больше здоровых тканей. Процедура включает постепенное удаление тонких слоев опухолевой ткани. Каждый последующий слой – его(После криосекции опухолевой ткани и проведения окрашивания H & E) дерматологом, чтобы определить, была ли удалена вся раковая ткань. Иссечение и исследование последующих слоев тканей выполняется, пока пациент остается в кабинете. Этот метод считается лучшим вариантом лечения для SCC 9 . В этот момент рана закрывается, и для улучшения исцеления и косметического эффекта часто вырезается смежная нормальная ткань (ANT). Таким образом, эта хирургическая процедура для удаления опухоли идеально подходит для сбора гистологически охарактеризованной ткани для будущих исследований.
Процедура закупок для получения опухолевой ткани, смежных нормальных тканей, слюны и образцов крови была разработана для минимального воздействия на обычные обязанности персонала ( рисунок 1 ). Медицинские помощники выполняют анализ крови при подготовке пациента к процедуре. После завершения процедуры Мооса M Ohs histotechnologist готовит дополнительные гистологические слайды образца и переносит ткань в биоресурсор. Затраты, связанные с созданием биоресурсов, включают покупку морозильных камер для морозильной камеры, создание скромного клинического лабораторного пространства и разработку программы отслеживания запасов.
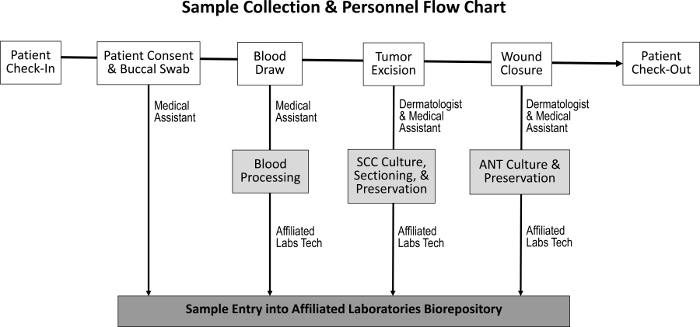
Рисунок 1: Последовательность сбора проб и ответственный персонал. После регистрации пациента и достижения согласия пациента медицинский ассистент собирает трансбуккальный тампон и выполняет забор крови. Дерматолог и медицинский ассистент затем вырезают опухоль и закрывают рану, в течение которой собирают образцы SCC и ANT, соответственно. Специализированный лаборант обрабатывает кровь и разделы SCC и ANT образцов для культуры тканей, сохранения и входа в биоресурсы.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Разнообразие собранных проб позволяет использовать различные экспериментальные подходы ( рис. 2 ). Образцами, собранными у пациента, являются щечные тампоны (слюна также может быть собрана при необходимости), цельная кровь и иссеченная ткань. Буккальные тампоны и образец из цельной крови сохраняются без обработки для генотипирования и подбора тканей. Цельная кровь разделяется на лейкоциты (WBC) и фракции плазмы для будущих анализов. После обработки Мооса замороженную опухоль помещают непосредственно в жидкий азот и переносят в морозильник -80 ° C. Свежую, жизнеспособную опухолевую ткань и образцы ANT культивируют с использованием модификаций предыдущих методик 10 , 11 и затем замораживают. Во время сбора данных количество каждого типа выборки записывается в электронную таблицу до Программа отслеживания запасов для упрощения точной обработки ( таблица 1 ).
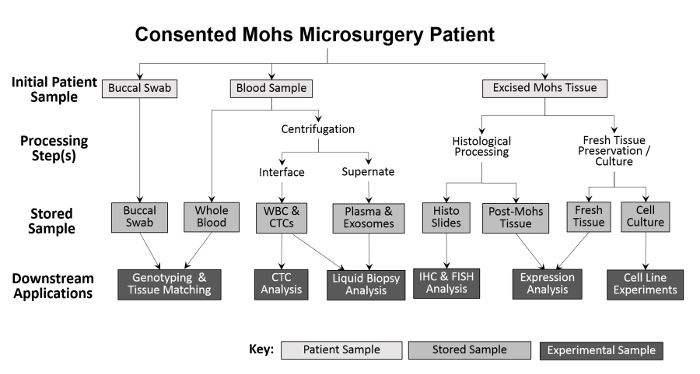
Рисунок 2: Схема сбора и обработки проб биоресурсов на базе клиник. Буккальный мазок и образец крови собираются у пациента и хранятся для последующего генотипирования и тканевого соответствия. Цельная кровь дополнительно обрабатывается для выделения белых кровяных клеток (WBC) и анализа CTC, а также для сбора плазмы и анализа жидкой биопсии. Ткань, вырезанная во время процедуры Мооса, гистологически обрабатывается в диагностических целях, после чего гистологические слайды могут быть использованы экспериментально для дальнейших иммуногистохимических анализов. При условии, что образец иссеченной ткани достаточно велик, часть свежей ткани удаляют и секционируют для выделения белков и РНК и для установления культивируемых клеточных линий.55583 / 55583fig1large.jpg "target =" _ blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Дата сбора: | |||||
| Пациент 1 | Пациент 2 | Пациент 3 | Пациент 4 | Пациент 5 | |
| Инициалы и дата рождения | |||||
| Цвет глаз | |||||
| Тип образца | |||||
| Пример местоположения | |||||
| слюна | |||||
| WДыра в крови | |||||
| плазма | |||||
| Опухоль жизнеспособна | |||||
| Ткань нормальная жизнеспособная | |||||
| Жидкий азот опухоли Мооса | |||||
| Ткань Нормальный жидкий азот | |||||
| Слайды |
Таблица 1: Контрольный список для записи выборочных наборов. Данные, отслеживаемые и регистрируемые с каждым собранным образцом, включают инициалы пациентов, дату рождения и цвет глаз (для опечатывания кожи), а также локатиНа удаление образца. Количество образцов слюны, объемы сбора крови и количество собранных жизнеспособных и консервированных образцов тканей также записываются в качестве ссылок для распределения для последующего использования. Нажмите здесь, чтобы загрузить этот файл.
Чтобы проверить процедуры сбора образцов, каждый тип образца был протестирован в последующих приложениях. Используя модификации предыдущих методик 12 , опухоль и ANT успешно используются в изоляции белков и РНК и могут потенциально использоваться для выделения ДНК. Жизнеспособные экспланты, созданные из срезов тканей, были оценены с помощью микроскопии, тогда как сохраненные гистологические слайды использовались для иммуногистохимии и иммунофлюоресценции.
Следуя описанному здесь протоколу, можно распространить эту модель на другие дерматологические клиники, другие типы опухолей (такие как меланома), И другие хирургические специальности и практики для обеспечения образцов человеческой ткани для многогранных исследований рака человека. Небольшие модификации этого протокола, вероятно, будут необходимы для других практик, но в принципе этот протокол применим к любой хирургической практике, которая рутинно отбирает образцы пациентов, собранные в ходе лечения пациента.
Protocol
Representative Results
Discussion
Насколько известно автору, этот протокол является первым в своем роде, который фокусируется на клинических закупках образцов кожных тканей как с точки зрения затрат, так и с быстрым подходом. Пациенты, проходящие микрохирургию Мооса, как правило, назначаются в определенные периоды вре…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана фондами из Колледжа медико-санитарных наук Университета штата Мидвестерн, предоставленными EEH, и Канцелярией исследований и спонсируемых программ Университета Среднего Запада, которая была присуждена KJL. Дополнительная поддержка была оказана аффилированными лабораториями и аффилированной дерматологией. Мы благодарим Сару Потехен, Джейми Барто, Стефани Фокса, Коди Джоржана, Стейси Шимке, Хезер Кисел и Али Заиди за их техническую помощь.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

