Isolatie van proximale vloeistoffen om de tumormicro-omgeving van pancreasadenocarcinoom te onderzoeken
Summary
Pancreassap is een kostbare bron van biomarkers voor menselijke alvleesklierkanker. We beschrijven hier een methode voor intraoperatieve incassoprocedure. Om de uitdaging van het aannemen van deze procedure in muizenmodellen te overwinnen, stellen we een alternatief monster voor, tumor interstitiële vloeistof, en beschrijven we hier twee protocollen voor de isolatie ervan.
Abstract
Pancreasadenocarcinoom (PDAC) is de vierde belangrijkste oorzaak van kankergerelateerde sterfte en binnenkort de tweede. Er is een dringende behoefte aan variabelen geassocieerd met specifieke pancreaspathologieën om preoperatieve differentiële diagnose en patiëntprofilering te helpen. Pancreassap is een relatief onontgonnen lichaamsvloeistof, die, vanwege de nabijheid van de tumorplaats, veranderingen in het omliggende weefsel weerspiegelt. Hier beschrijven we in detail de intraoperatieve incassoprocedure. Helaas is het vertalen van pancreassapverzameling naar muizenmodellen van PDAC, om mechanistische studies uit te voeren, technisch zeer uitdagend. Tumor interstitiële vloeistof (TIF) is de extracellulaire vloeistof, buiten bloed en plasma, die tumor- en stromale cellen baadt. Net als bij pancreassap, voor zijn eigenschap om moleculen te verzamelen en te concentreren die verdund in plasma worden aangetroffen, kan TIF worden gebruikt als een indicator van veranderingen in de micro-omgeving en als een waardevolle bron van ziekte-geassocieerde biomarkers. Omdat TIF niet gemakkelijk toegankelijk is, zijn verschillende technieken voorgesteld voor de isolatie ervan. We beschrijven hier twee eenvoudige en technisch niet veeleisende methoden voor de isolatie ervan: weefselcentrifugatie en weefselelutie.
Introduction
Pancreas ductaal adenocarcinoom (PDAC) is een van de meest agressieve tumoren en wordt binnenkort de tweede belangrijkste doodsoorzaak 1,2,3. Het staat bekend om zijn immunosuppressieve micro-omgeving en om zijn niet-responsiviteit op immunotherapieprotocollen4. Momenteel is chirurgische resectie nog steeds de enige curatieve optie voor PDAC, maar er is een hoge frequentie van vroege recidieven en postoperatieve complicaties. Het ontbreken van specifieke symptomen tot een vergevorderd stadium maakt een vroege diagnose niet mogelijk, wat bijdraagt aan de deadlines van de ziekte. Bovendien kan de overlap van symptomen tussen PDAC en andere goedaardige pancreaspathologieën het bereiken van een snelle en betrouwbare diagnose met de huidige diagnostische strategieën belemmeren. De identificatie van variabelen geassocieerd met specifieke pancreaspathologieën kan het chirurgische besluitvormingsproces vergemakkelijken en de patiëntprofilering verbeteren.
Veelbelovende resultaten bij het ontdekken van biomarkers zijn bereikt met behulp van gemakkelijk toegankelijke lichaamsvloeistoffen, zoals bloed 5,6,7, urine8, speeksel9 en pancreassap 10,11,12. Veel studies hebben gebruik gemaakt van uitgebreide “omics” -benaderingen, zoals genomische, proteomische en metabolomische technieken, om kandidaat-moleculen of handtekeningen te identificeren die onderscheid kunnen maken tussen PDAC en andere goedaardige pancreasaandoeningen. We hebben onlangs aangetoond dat pancreassap, een relatief onontgonnen lichaamsvloeistof, kan worden gebruikt om metabole handtekeningen van patiënten met verschillende klinische profielen te identificeren12. Pancreassap is een eiwitrijke vloeistof, die het secretoom van pancreaskanaal verzamelt en naar het hoofdkanaal van de pancreas stroomt en vervolgens naar het belangrijkste gemeenschappelijke galkanaal. Vanwege de nabijheid van de alvleesklier kan het sterk worden beïnvloed door micromilieuverstoringen veroorzaakt door de tumormassa (figuur 1), en daarom informatiever dan bloed of urine, of op weefsel gebaseerde profilering. Verschillende studies hebben het potentieel van pancreassap onderzocht om nieuwe biomarkers van ziekten te identificeren met behulp van verschillende benaderingen, waaronder cytologische analyse13, proteomische analyse uitgevoerd door massaspectrometrie14,15, beoordeling van genetische en epigenetische markers zoals K-ras– en p53-mutaties 16,17, veranderingen in DNA-methylatie18 en miRNA’s19 . Technisch gezien kan pancreassap intraoperatief of met minimaal invasieve procedures worden verzameld, zoals endoscopische echografie, retrograde cholangio-pancreatografie of door endoscopische verzameling van duodenale sapsecretie20. Het is nog niet duidelijk in hoeverre de samenstelling van pancreassap wordt beïnvloed door de gebruikte verzameltechniek. We beschrijven hier de intraoperatieve verzamelprocedure en tonen aan dat pancreassap een kostbare bron kan zijn voor PDAC-biomarkers.
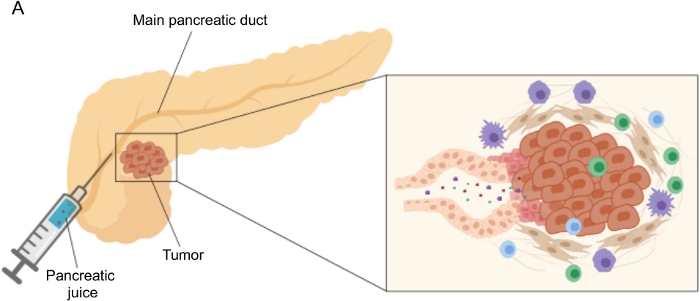
Figuur 1: Schematische weergave van de verzameling van pancreassap. (A) Schematische weergave van de afscheiding van pancreassap in de pancreaskanalen en de verzameling ervan tijdens de operatie. De inzet toont een close-up van de micro-omgeving van de tumor: pancreassap verzamelt moleculen die vrijkomen door tumor- en stromale cellen in de pancreaskanalen. Klik hier om een grotere versie van deze figuur te bekijken.
Het verzamelen van pancreassap in genetische en orthotopische muismodellen van PDAC zou worden gewaardeerd in het perspectief om deze biofluïde te exploiteren in preklinische mechanistische studies; deze procedure kan echter technisch zeer uitdagend zijn en is niet haalbaar voor eenvoudigere modellen zoals subcutane tumoren. Om deze reden identificeerden we tumor interstitiële vloeistof (TIF) als een alternatieve bron voor pancreassap, vanwege het vergelijkbare kenmerk van het fungeren als een indicator van omliggende verstoringen. Interstitiële vloeistof (IF) is de extracellulaire vloeistof, gevonden buiten bloed- en lymfevaten, die weefselcellen baadt21. ALS de samenstelling wordt beïnvloed door zowel de bloedcirculatie naar het orgaan als de lokale secretie; in feite produceren en scheiden omliggende cellen actief eiwitten af in de IF21. Het interstitium weerspiegelt micromilieuveranderingen van omliggende weefsels en kan daarom een waardevolle bron zijn voor biomarkerontdekking in verschillende pathologische contexten, zoals tumoren. De hoge concentratie van lokaal uitgescheiden eiwitten in TIF kan worden gebruikt om kandidaat-moleculen te identificeren die moeten worden getest als prognostische of diagnostische biomarkers in plasma 22,23,24. Verschillende studies hebben aangetoond dat TIF een geschikt monster is voor proteomische benaderingen met hoge doorvoer, zoals massaspectrometrietechnieken23,24,25, evenals multiplex ELISA-benaderingen26 en microRNA-profilering27.
Er zijn verschillende benaderingen voorgesteld voor de isolatie van IF in tumoren, die in grote lijnen kunnen worden gecategoriseerd als in vivo (capillaire ultrafiltratie 28,29,30,31 en microdialyse 32,33,34,35) en ex vivo methoden (weefselcentrifugatie 22,36,37,38 en weefselelution 39,40,41,42). Deze technieken zijn uitgebreid besproken43,44. Bij de keuze van de geschikte methode moet rekening worden gehouden met zaken als de downstreamanalyses en -toepassingen en het teruggewonnen volume. We hebben deze aanpak onlangs gebruikt als een proof of principle om de verschillende metabole activiteit van tumoren van twee muizen pancreas adenocarcinoom cellijnen12 aan te tonen. Op basis van literatuur24,38 hebben we ervoor gekozen om de lage snelheid centrifugatiemethode te gebruiken om celbreuk en verdunning door intracellulaire inhoud te voorkomen. Zowel de hoeveelheid glucose als lactaat in TIF weerspiegelden de verschillende glycolytische kenmerken van de twee verschillende cellijnen. Hier beschrijven we in detail het protocol voor de twee meest gebruikte methoden voor de isolatie van TIF: weefselcentrifugatie en weefselelutie (figuur 2).
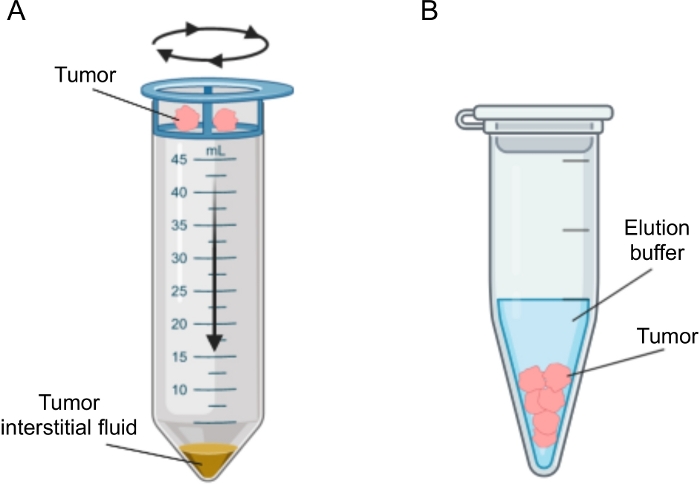
Figuur 2: Schematische weergave van tumor interstitiële vloeistofisolatiemethoden. Schematische illustratie van de in detail beschreven technieken in het protocol, namelijk weefselcentrifugatie (A) en weefselelutie (B). Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
In deze studie hebben we de techniek beschreven om intraoperatief pancreassap te verzamelen, een grotendeels onontgonnen vloeistofbiopsie. We hebben onlangs aangetoond dat pancreassap kan worden gebruikt als een bron van metabole markers van ziekte12. Metabolomische analyse op andere vloeibare biopten, zoals bloed 5,6,7, urine8 en speeksel9, hebben veelbelov…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Wij danken Roberta Migliore voor de technische bijstand. Het onderzoek dat tot deze resultaten heeft geleid, heeft financiering ontvangen van Associazione Italiana per la ricerca sul cancro (AIRC) in het kader van het IG2016-ID.18443-project – P.I. Marchesi Federica. De financiers hadden geen rol in studieontwerp, gegevensverzameling en -analyse, beslissing om te publiceren of voorbereiding van het manuscript.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
References
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Recherche en cancérologie. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

