Isolamento de Fluidos Proximais para Investigar o Microambiente Tumoral do Adenocarcinoma Pancreático
Summary
O suco pancreático é uma fonte preciosa de biomarcadores para o câncer de pâncreas humano. Descrevemos aqui um método para o procedimento de coleta intraoperatória. Para superar o desafio de adotar esse procedimento em modelos murinos, sugerimos uma amostra alternativa, o líquido intersticial tumoral, e descrevemos aqui dois protocolos para seu isolamento.
Abstract
O adenocarcinoma pancreático (PDAC) é a quarta principal causa de morte relacionada ao câncer e logo se tornará a segunda. Há uma necessidade urgente de variáveis associadas a patologias pancreáticas específicas para auxiliar o diagnóstico diferencial pré-operatório e o perfil do paciente. O suco pancreático é um fluido corporal relativamente inexplorado, que, devido à sua proximidade com o local do tumor, reflete mudanças no tecido circundante. Aqui descrevemos detalhadamente o procedimento de coleta intraoperatória. Infelizmente, traduzir a coleta de suco pancreático para modelos murinos de PDAC, para realizar estudos mecanicistas, é tecnicamente muito desafiador. O líquido intersticial tumoral (TIF) é o fluido extracelular, fora do sangue e do plasma, que banha as células tumorais e estromais. Da mesma forma que o suco pancreático, por sua propriedade de coletar e concentrar moléculas que são encontradas diluídas no plasma, o TIF pode ser explorado como um indicador de alterações microambientais e como uma valiosa fonte de biomarcadores associados à doença. Como o TIF não é facilmente acessível, várias técnicas têm sido propostas para o seu isolamento. Descrevemos aqui dois métodos simples e tecnicamente pouco exigentes para o seu isolamento: centrifugação tecidual e eluição tecidual.
Introduction
O adenocarcinoma ductal pancreático (ACPD) é um dos tumores mais agressivos, e logo se tornará a segunda principal causa de morte 1,2,3. É conhecida por seu microambiente imunossupressor e por sua falta de resposta aos protocolos de imunoterapia4. Atualmente, a ressecção cirúrgica ainda é a única opção curativa para a ACPD, mas há uma alta frequência de recidivas precoces e complicações pós-cirúrgicas. A falta de sintomas específicos até um estágio avançado não permite um diagnóstico precoce, contribuindo para os prazos da doença. Além disso, a sobreposição de sintomas entre o PDAC e outras patologias pancreáticas benignas pode dificultar a obtenção de um diagnóstico rápido e confiável com as estratégias diagnósticas atuais. A identificação de variáveis associadas a patologias pancreáticas específicas poderia facilitar o processo de tomada de decisão cirúrgica e melhorar o perfil do paciente.
Resultados promissores na descoberta de biomarcadores têm sido alcançados utilizando fluidos corporais de fácil acesso, como sangue 5,6,7, urina8, saliva 9 e suco pancreático10,11,12. Muitos estudos exploraram abordagens “ômicas” abrangentes, como técnicas genômicas, proteômicas e metabolômicas, para identificar moléculas ou assinaturas candidatas que poderiam discriminar entre PDAC e outras aflições pancreáticas benignas. Recentemente, demonstramos que o suco pancreático, um fluido corporal relativamente inexplorado, pode ser utilizado para identificar assinaturas metabólicas de pacientes com perfis clínicos distintos12. O suco pancreático é um fluido rico em proteínas, que acumula o secretoma das células ductais pancreáticas e flui para o ducto pancreático principal e, em seguida, para o ducto biliar comum principal. Devido à sua proximidade com o pâncreas, pode ser fortemente afetada por perturbações microambientais induzidas pela massa tumoral (Figura 1) e, portanto, mais informativa do que o sangue ou a urina, ou o perfil baseado em tecidos. Vários estudos têm explorado o potencial do suco pancreático para identificar novos biomarcadores de doença usando várias abordagens, incluindo análise citológica 13, análise proteômica realizada por espectrometria de massa14,15, avaliação de marcadores genéticos e epigenéticos como mutações K-ras e p53 16,17, alterações na metilação do DNA 18 e miRNAs 19 . Tecnicamente, o suco pancreático pode ser coletado no intraoperatório ou com procedimentos minimamente invasivos, como ultrassonografia endoscópica, colangiopancreatografia retrógrada ou por coleta endoscópica de secreção de suco duodenal20. Ainda não está claro até que ponto a composição do suco pancreático é afetada pela técnica de coleta utilizada. Descrevemos aqui o procedimento de coleta intraoperatória e mostramos que o suco pancreático pode representar uma fonte preciosa de biomarcadores PDAC.
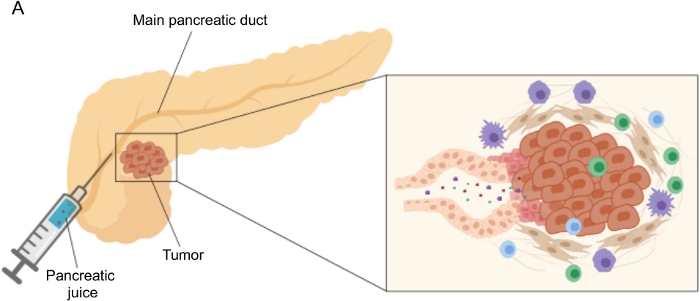
Figura 1: Representação esquemática da coleção de suco pancreático. (A) Representação esquemática que descreve a secreção de suco pancreático no ducto pancreático e sua coleta durante a cirurgia. A inserção mostra um close-up do microambiente tumoral: o suco pancreático coleta moléculas liberadas por células tumorais e estromais nos ductos pancreáticos. Por favor, clique aqui para ver uma versão maior desta figura.
A coleta de suco pancreático em modelos genéticos e ortotópicos de camundongos de PDAC seria apreciada na perspectiva de explorar esse biofluido em estudos mecanicistas pré-clínicos; no entanto, esse procedimento pode ser tecnicamente muito desafiador e inviável para modelos mais simples, como tumores subcutâneos. Por esse motivo, identificamos o líquido intersticial tumoral (TIF) como uma fonte alternativa ao suco pancreático, por sua característica semelhante de atuar como um indicador de perturbações circundantes. O líquido intersticial (FI) é o líquido extracelular, encontrado fora dos vasos sanguíneos e linfáticos, que banha as células teciduais21. A composição do FI é afetada tanto pela circulação sanguínea para o órgão quanto pela secreção local; de fato, as células circundantes produzem e secretam ativamente proteínas no FI21. O interstício reflete as alterações microambientais dos tecidos circundantes e, portanto, pode representar uma fonte valiosa para a descoberta de biomarcadores em vários contextos patológicos, como tumores. A alta concentração de proteínas secretadas localmente no TIF pode ser utilizada para identificar moléculas candidatas a serem testadas como biomarcadores prognósticos ou diagnósticos no plasma22,23,24. Vários estudos comprovaram que o TIF é uma amostra adequada para abordagens proteômicas de alto rendimento, como técnicas de espectrometria de massa 23,24,25, bem como abordagens ELISA multiplex 26 e perfil de microRNA 27.
Diversas abordagens têm sido propostas para o isolamento do FI em tumores, que podem ser amplamente categorizados como in vivo (ultrafiltração capilar 28,29,30,31 e microdiálise 32,33,34,35) e métodos ex vivo (centrifugação tecidual 22,36,37,38 e eluição tecidual 39,40,41,42). Essas técnicas têm sido revisadas em detalhesextensivos 43,44. A escolha do método adequado deverá ter em conta questões como as análises e aplicações a jusante e o volume recuperado. Recentemente, utilizamos essa abordagem como prova de princípio para demonstrar a diferente atividade metabólica de tumores de duas linhagens celulares de adenocarcinoma pancreático murino12. Com base na literatura24,38, optou-se por utilizar o método de centrifugação de baixa velocidade para evitar a quebra celular e a diluição do conteúdo intracelular. Tanto a quantidade de glicose quanto o lactato no TIF refletiram as diferentes características glicolíticas das duas linhagens celulares diferentes. Aqui descrevemos detalhadamente o protocolo para os dois métodos mais utilizados para o isolamento de TIF: centrifugação tecidual e eluição tecidual (Figura 2).
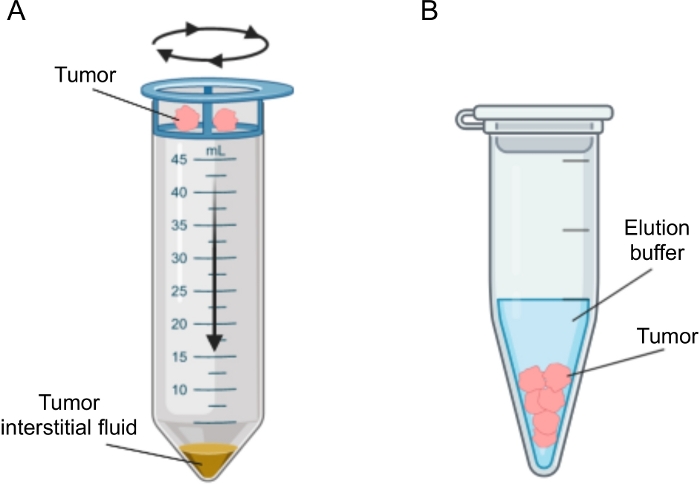
Figura 2: Representação esquemática dos métodos de isolamento do líquido intersticial tumoral. Ilustração esquemática das técnicas descritas detalhadamente no protocolo, nomeadamente centrifugação tecidual (A) e eluição tecidual (B). Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Neste estudo, descrevemos a técnica de coleta intraoperatória de suco pancreático, uma biópsia de fluidos em grande parte inexplorada. Recentemente, mostramos que o suco pancreático pode ser explorado como fonte de marcadores metabólicos da doença12. A análise metabolômica em outras biópsias líquidas, como sangue 5,6,7, urina8 e saliva9, mostrou r…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Roberta Migliore pela assistência técnica. A pesquisa que levou a esses resultados recebeu financiamento da Associazione Italiana per la ricerca sul cancro (AIRC) no âmbito do projeto IG2016-ID.18443 – P.I. Marchesi Federica. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
References
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Recherche en cancérologie. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

