Isolering av proximala vätskor för att undersöka tumörmikromiljön i bukspottskörtelns adenokarcinom
Summary
Bukspottkörteljuice är en värdefull källa till biomarkörer för human bukspottkörtelcancer. Vi beskriver här en metod för intraoperativ insamlingsprocedur. För att övervinna utmaningen att anta denna procedur i murina modeller föreslår vi ett alternativt prov, tumörinterstitiell vätska, och beskriver här två protokoll för dess isolering.
Abstract
Pankreas adenokarcinom (PDAC) är den fjärde ledande orsaken till cancerrelaterad död och snart den andra. Det finns ett akut behov av variabler associerade med specifika pankreaspatologier för att hjälpa preoperativ differentialdiagnos och patientprofilering. Bukspottkörteljuice är en relativt outforskad kroppsvätska, som på grund av sin närhet till tumörstället återspeglar förändringar i den omgivande vävnaden. Här beskriver vi i detalj det intraoperativa insamlingsförfarandet. Tyvärr är det tekniskt mycket utmanande att översätta pankreasjuicesamling till murina modeller av PDAC, för att utföra mekanistiska studier. Tumörinterstitiell vätska (TIF) är den extracellulära vätskan, utanför blod och plasma, som badar tumör- och stromaceller. På samma sätt som bukspottkörteljuice, för dess egenskap att samla och koncentrera molekyler som finns utspädda i plasma, kan TIF utnyttjas som en indikator på mikromiljöförändringar och som en värdefull källa till sjukdomsassocierade biomarkörer. Eftersom TIF inte är lättillgängligt har olika tekniker föreslagits för dess isolering. Vi beskriver här två enkla och tekniskt krävande metoder för dess isolering: vävnadscentrifugering och vävnadsel.
Introduction
Pankreatiskt duktalt adenokarcinom (PDAC) är en av de mest aggressiva tumörerna och kommer snart att bli den näst vanligaste dödsorsaken 1,2,3. Det är välkänt för sin immunsuppressiva mikromiljö och för sin svarslöshet på immunterapiprotokoll4. För närvarande är kirurgisk resektion fortfarande det enda botande alternativet för PDAC, men det finns en hög frekvens av tidiga återfall och posturgiska komplikationer. Bristen på specifika symtom tills ett avancerat stadium tillåter inte en tidig diagnos, vilket bidrar till sjukdomens tidsfrister. Dessutom kan överlappningen av symtom mellan PDAC och andra godartade pankreaspatologier hindra uppnåendet av en snabb och tillförlitlig diagnos med de nuvarande diagnostiska strategierna. Identifieringen av variabler associerade med specifika pankreaspatologier kan underlätta den kirurgiska beslutsprocessen och förbättra patientprofilering.
Lovande resultat i biomarkörupptäckt har uppnåtts med hjälp av lättillgängliga kroppsvätskor, såsom blod 5,6,7, urin8, saliv 9 och bukspottkörteljuice10,11,12. Många studier har utnyttjat omfattande “omics” -metoder, såsom genomiska, proteomiska och metabolomiska tekniker, för att identifiera kandidatmolekyler eller signaturer som kan skilja mellan PDAC och andra godartade bukspottkörtelbesvär. Vi visade nyligen att bukspottkörteljuice, en relativt outforskad kroppsvätska, kan användas för att identifiera metaboliska signaturer hos patienter med distinkta kliniska profiler12. Bukspottkörteljuice är en proteinrik vätska som ackumulerar sekretomet hos bukspottkörtelkanalceller och strömmar till huvudkanalen i bukspottkörteln och sedan till den huvudsakliga gemensamma gallkanalen. På grund av dess närhet till bukspottkörteln kan den påverkas starkt av mikromiljöstörningar inducerade av tumörmassan (figur 1) och därför mer informativ än blod eller urin eller vävnadsbaserad profilering. Flera studier har undersökt potentialen hos bukspottkörteljuice för att identifiera nya biomarkörer för sjukdom med hjälp av olika tillvägagångssätt, inklusive cytologisk analys 13, proteomisk analys utförd med masspektrometri 14,15, bedömning av genetiska och epigenetiska markörer såsom K-ras och p53-mutationer 16,17, förändringar i DNA-metylering18 och miRNA 19 . Tekniskt sett kan bukspottkörteljuice samlas intraoperativt eller med minimalt invasiva procedurer, såsom endoskopisk ultraljud, retrograd kolangio-pankreatografi eller genom endoskopisk insamling av duodenal juicesekretion20. Det är ännu inte klart i vilken utsträckning bukspottskörteljuicekompositionen påverkas av den använda insamlingstekniken. Vi beskriver här det intraoperativa insamlingsförfarandet och visar att bukspottkörteljuice kan utgöra en värdefull källa för PDAC-biomarkörer.
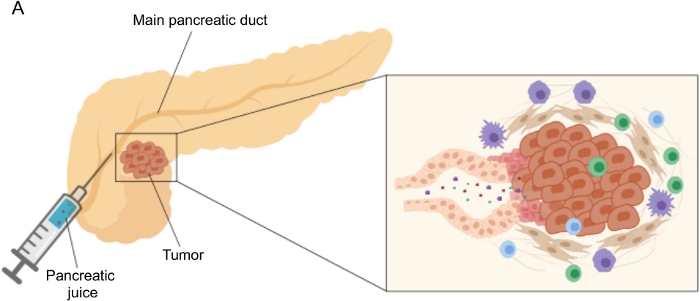
Figur 1: Schematisk representation av pankreasjuice samling. (A) Schematisk representation som visar utsöndringen av bukspottkörteljuice i bukspottkörtelkanalen och dess samling under operationen. Insatsen visar en närbild av tumörmikromiljön: bukspottkörteljuice samlar molekyler som frigörs av tumör- och stromaceller i bukspottkörtelkanalerna. Klicka här för att se en större version av denna siffra.
Insamlingen av bukspottkörteljuice i genetiska och ortotopiska musmodeller av PDAC skulle uppskattas i perspektivet att utnyttja denna biofluid i prekliniska mekanistiska studier; Denna procedur kan dock vara tekniskt mycket utmanande och är inte genomförbar för enklare modeller som subkutana tumörer. Av denna anledning identifierade vi tumörinterstitiell vätska (TIF) som en alternativ källa till bukspottkörteljuice, för dess liknande egenskap att fungera som en indikator på omgivande störningar. Interstitiell vätska (IF) är den extracellulära vätskan, som finns utanför blod och lymfkärl, som badar vävnadsceller21. IF-kompositionen påverkas av både blodcirkulationen till organet och lokal utsöndring; i själva verket producerar och utsöndrar omgivande celler aktivt proteiner i IF21. Interstitium återspeglar mikromiljöförändringar i omgivande vävnader och kan därför utgöra en värdefull källa för biomarkörupptäckt i flera patologiska sammanhang, såsom tumörer. Den höga koncentrationen av lokalt utsöndrade proteiner i TIF kan användas för att identifiera kandidatmolekyler som ska testas som prognostiska eller diagnostiska biomarkörer i plasma22,23,24. Flera studier har visat att TIF är ett lämpligt prov för proteomiska metoder med hög genomströmning, såsom masspektrometritekniker 23,24,25, samt multiplex ELISA-tillvägagångssätt 26 och mikroRNA-profilering 27.
Flera tillvägagångssätt har föreslagits för isolering av IF i tumörer, som i stort sett kan kategoriseras som de vivo (kapillär ultrafiltrering 28,29,30,31 och mikrodialys 32,33,34,35) och ex vivo-metoder (vävnadscentrifugering 22,36,37,38 och vävnadseluering 39,40,41,42). Dessa tekniker har granskats i detalj43,44. Vid valet av lämplig metod bör hänsyn tas till frågor som analyser och tillämpningar i senare led och den återvunna volymen. Vi använde nyligen detta tillvägagångssätt som ett principbevis för att visa den olika metaboliska aktiviteten hos tumörer från två murina pankreas adenokarcinomcellinjer12. Baserat på litteratur 24,38 valde vi att använda låghastighetscentrifugeringsmetoden för att undvika cellbrott och utspädning från intracellulärt innehåll. Både mängden glukos och laktat i TIF återspeglade de olika glykolytiska egenskaperna hos de två olika cellinjerna. Här beskriver vi i detalj protokollet för de två vanligaste metoderna för isolering av TIF: vävnadscentrifugering och vävnadseluering (figur 2).
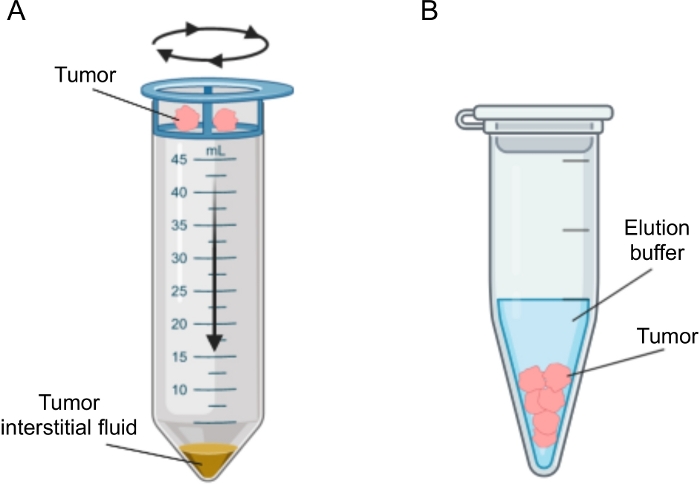
Figur 2: Schematisk representation av tumörinterstitiella vätskeisoleringsmetoder. Schematisk illustration av de tekniker som beskrivs i detalj i protokollet, nämligen vävnadscentrifugering (A) och vävnadsel (B). Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
I denna studie har vi beskrivit tekniken för att intraoperativt samla bukspottkörteljuice, en i stort sett outforskad vätskebiopsi. Vi har nyligen visat att bukspottkörteljuice kan utnyttjas som en källa till metaboliska markörer för sjukdom12. Metabolomisk analys på andra flytande biopsier, såsom blod 5,6,7, urin8 och saliv9, har visat lovande resu…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi tackar Roberta Migliore för tekniskt stöd. Forskningen som leder till dessa resultat har fått finansiering från Associazione Italiana per la ricerca sul cancro (AIRC) under IG2016-ID.18443-projektet – PI Marchesi Federica. Finansiärerna hade ingen roll i studiedesign, datainsamling och analys, beslut att publicera eller förberedelse av manuskriptet.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
References
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Recherche en cancérologie. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

