Isolering af proksimale væsker for at undersøge tumormikromiljøet af pancreas adenocarcinom
Summary
Bugspytkirtelsaft er en dyrebar kilde til biomarkører for kræft i bugspytkirtlen. Vi beskriver her en metode til intraoperativ indsamlingsprocedure. For at overvinde udfordringen med at vedtage denne procedure i murinemodeller foreslår vi en alternativ prøve, tumor interstitiel væske, og beskriver her to protokoller for dens isolering.
Abstract
Pancreas adenocarcinom (PDAC) er den fjerde førende årsag til kræftrelateret død og snart at blive den anden. Der er et presserende behov for variabler forbundet med specifikke bugspytkirtelpatologier for at hjælpe præoperativ differentialdiagnose og patientprofilering. Pancreasjuice er en relativt uudforsket kropsvæske, som på grund af sin nærhed til tumorstedet afspejler ændringer i det omgivende væv. Her beskriver vi detaljeret den intraoperative indsamlingsprocedure. Desværre er oversættelse af bugspytkirtelsaftsamling til murinemodeller af PDAC til udførelse af mekanistiske undersøgelser teknisk meget udfordrende. Tumor interstitiel væske (TIF) er den ekstracellulære væske uden for blod og plasma, som bader tumor- og stromalceller. På samme måde som bugspytkirtelsaft, for dets egenskab til at indsamle og koncentrere molekyler, der findes fortyndet i plasma, kan TIF udnyttes som en indikator for mikromiljømæssige ændringer og som en værdifuld kilde til sygdomsassocierede biomarkører. Da TIF ikke er let tilgængelig, er der foreslået forskellige teknikker til isolering. Vi beskriver her to enkle og teknisk krævende metoder til isolering: vævscentrifugering og vævseluering.
Introduction
Pankreatisk duktalt adenocarcinom (PDAC) er en af de mest aggressive tumorer og snart at blive den næststørste dødsårsag 1,2,3. Det er kendt for sit immunsuppressive mikromiljø og for dets manglende reaktion på immunterapiprotokoller4. I øjeblikket er kirurgisk resektion stadig den eneste helbredende mulighed for PDAC, men alligevel er der en høj frekvens af tidlige tilbagefald og postkirurgiske komplikationer. Manglen på specifikke symptomer indtil et avanceret stadium tillader ikke en tidlig diagnose, hvilket bidrager til sygdommens deadlines. Desuden kan overlapningen af symptomer mellem PDAC og andre godartede bugspytkirtelpatologier hæmme opnåelsen af en hurtig og pålidelig diagnose med de nuværende diagnostiske strategier. Identifikation af variabler forbundet med specifikke bugspytkirtelpatologier kan lette den kirurgiske beslutningsproces og forbedre patientprofilering.
Lovende resultater i biomarkøropdagelse er opnået ved hjælp af let tilgængelige kropsvæsker, såsom blod 5,6,7, urin8, spyt 9 og bugspytkirtelsaft10,11,12. Mange undersøgelser har udnyttet omfattende “omics” tilgange, såsom genomiske, proteomiske og metabolomiske teknikker, til at identificere kandidatmolekyler eller signaturer, der kan diskriminere mellem PDAC og andre godartede pancreas lidelser. Vi har for nylig demonstreret, at bugspytkirtelsaft, en relativt uudforsket kropsvæske, kan bruges til at identificere metaboliske signaturer hos patienter med forskellige kliniske profiler12. Bugspytkirtelsaft er en proteinrig væske, som akkumulerer sekretomet af bugspytkirtelkanalerne og strømmer til hovedbugspytkirtelkanalen og derefter til den vigtigste fælles galdekanal. På grund af dets nærhed til bugspytkirtlen kan det blive stærkt påvirket af mikromiljøforstyrrelser induceret af tumormassen (figur 1) og derfor mere informativ end blod eller urin eller vævsbaseret profilering. Flere undersøgelser har undersøgt potentialet i bugspytkirtelsaft til at identificere nye biomarkører for sygdom ved hjælp af forskellige tilgange, herunder cytologisk analyse13, proteomisk analyse udført ved massespektrometri 14,15, vurdering af genetiske og epigenetiske markører såsom K-ras og p53 mutationer 16,17, ændringer i DNA-methylering 18 og miRNA’er 19 . Teknisk set kan bugspytkirtelsaft indsamles intraoperativt eller med minimalt invasive procedurer, såsom endoskopisk ultralyd, retrograd cholangio-pancreatografi eller ved endoskopisk samling af duodenal juice sekretion20. Det er endnu ikke klart, i hvilket omfang pancreasjuicesammensætningen påvirkes af den anvendte indsamlingsteknik. Vi beskriver her den intraoperative indsamlingsprocedure og viser, at bugspytkirtelsaft kan repræsentere en dyrebar kilde til PDAC-biomarkører.
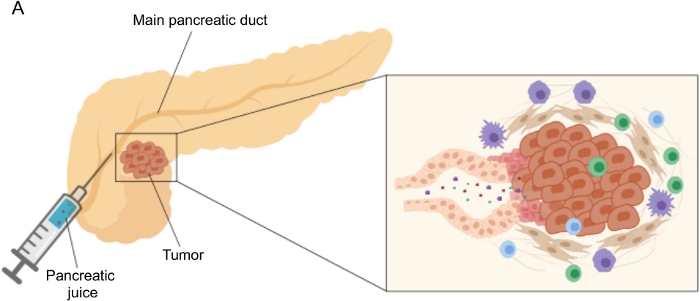
Figur 1: Skematisk repræsentation af pancreas juice samling. (A) Skematisk repræsentation, der viser udskillelsen af bugspytkirtelsaft i bugspytkirtelkanalen og dens samling under operationen. Indsatsen viser et nærbillede af tumormikromiljøet: bugspytkirtelsaft samler molekyler frigivet af tumor- og stromale celler i bugspytkirtelkanalerne. Klik her for at se en større version af denne figur.
Indsamlingen af bugspytkirtelsaft i genetiske og ortopiske musemodeller af PDAC ville blive værdsat i perspektivet for at udnytte denne biofluid i prækliniske mekanistiske undersøgelser; Denne procedure kan dog være teknisk meget udfordrende og er ikke mulig for enklere modeller såsom subkutane tumorer. Af denne grund identificerede vi tumor interstitiel væske (TIF) som en alternativ kilde til bugspytkirtelsaft for dets lignende egenskab ved at fungere som en indikator for omgivende forstyrrelser. Interstitiel væske (IF) er den ekstracellulære væske, der findes uden for blod og lymfekar, som bader vævsceller21. IF-sammensætningen påvirkes af både blodcirkulationen til organet og lokal sekretion; faktisk producerer og udskiller omgivende celler aktivt proteiner i IF21. Interstitium afspejler mikromiljømæssige ændringer i omgivende væv og kan derfor udgøre en værdifuld kilde til biomarkøropdagelse i flere patologiske sammenhænge, såsom tumorer. Den høje koncentration af lokalt udskilte proteiner i TIF kan bruges til at identificere kandidatmolekyler, der skal testes som prognostiske eller diagnostiske biomarkører i plasma22,23,24. Flere undersøgelser har vist, at TIF er en passende prøve til proteomiske tilgange med høj kapacitet, såsom massespektrometriteknikker 23,24,25 samt multiplex ELISA-tilgange 26 og mikroRNA-profilering 27.
Der er foreslået flere metoder til isolering af IF i tumorer, som bredt kan kategoriseres som in vivo (kapillær ultrafiltrering 28,29,30,31 og mikrodialyse 32,33,34,35) og ex vivo-metoder (vævscentrifugering 22,36,37,38 og vævseluation 39,40,41,42). Disse teknikker er blevet gennemgået i omfattende detaljer43,44. Ved valget af den passende metode bør der tages hensyn til spørgsmål som f.eks. downstreamanalyser og applikationer og den genvundne mængde. Vi brugte for nylig denne tilgang som et bevis på princippet for at demonstrere den forskellige metaboliske aktivitet af tumorer fra to murine pancreas adenocarcinom cellelinjer12. Baseret på litteratur 24,38 valgte vi at bruge lavhastighedscentrifugeringsmetoden for at undgå cellebrud og fortynding fra intracellulært indhold. Både mængden af glukose og laktat i TIF afspejlede de forskellige glykolytiske egenskaber ved de to forskellige cellelinjer. Her beskriver vi detaljeret protokollen for de to mest almindeligt anvendte metoder til isolering af TIF: vævscentrifugering og vævseluering (figur 2).
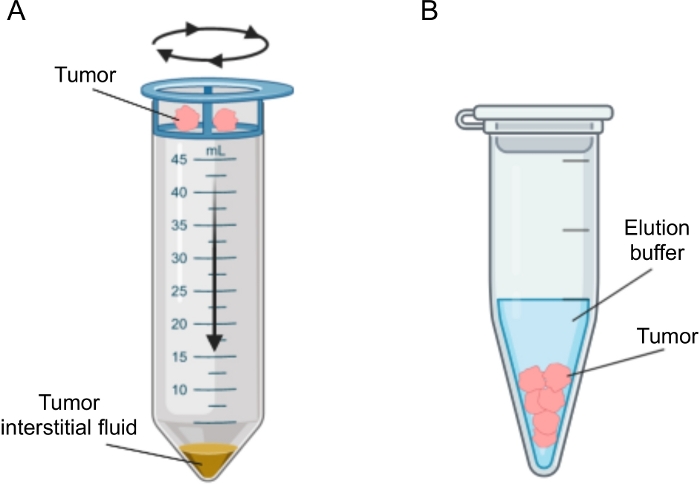
Figur 2: Skematisk repræsentation af tumor interstitielle væskeisoleringsmetoder. Skematisk illustration af de teknikker, der er beskrevet detaljeret i protokollen, nemlig vævscentrifugering (A) og vævseluering (B). Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
I denne undersøgelse har vi beskrevet teknikken til intraoperativt at indsamle bugspytkirtelsaft, en stort set uudforsket væskebiopsi. Vi har for nylig vist, at bugspytkirtelsaft kan udnyttes som en kilde til metaboliske markører for sygdom12. Metabolomisk analyse af andre flydende biopsier, såsom blod 5,6,7, urin8 og spyt9, har vist lovende resultater i…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi takker Roberta Migliore for teknisk bistand. Forskningen, der fører til disse resultater, har modtaget finansiering fra Associazione Italiana per la ricerca sul cancro (AIRC) under IG2016-ID.18443-projektet – P.I. Marchesi Federica. Finansieringskilderne havde ingen rolle i undersøgelsesdesign, dataindsamling og analyse, beslutning om at offentliggøre eller forberedelse af manuskriptet.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
References
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Recherche en cancérologie. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

