Outils pour l’évaluation en temps réel d’un modèle d’infection à Pseudomonas aeruginosa
Summary
Les expectorations synthétiques de la fibrose kystique (SCFM2) peuvent être utilisées en combinaison avec la microscopie confocale à balayage laser et le tri cellulaire activé par fluorescence pour observer les agrégats bactériens à haute résolution. Cet article détaille les méthodes permettant d’évaluer les populations agrégées pendant le traitement antimicrobien en tant que plate-forme pour de futures études.
Abstract
Pseudomonas aeruginosa (Pa) est l’un des agents pathogènes opportunistes les plus courants associés à la fibrose kystique (FK). Une fois la colonisation pa établie, une grande partie des bactéries infectieuses forment des biofilms dans les expectorations des voies respiratoires. Il a été démontré que les biofilms de Pa isolés des expectorations de la FK se développent en petits agrégats denses d’environ 10 à 1 000 cellules qui sont organisés spatialement et présentent des phénotypes cliniquement pertinents tels que la tolérance aux antimicrobiens. L’un des plus grands défis de l’étude de la façon dont les agrégats de Pa réagissent à l’environnement changeant des expectorations est le manque de systèmes pertinents et robustes sur le plan nutritionnel qui favorisent la formation d’agrégats. À l’aide d’un milieu synthétique d’expectorations CF (SCFM2), l’histoire de vie des agrégats de Pa peut être observée à l’aide de la microscopie confocale à balayage laser (CLSM) et de l’analyse d’images à la résolution d’une seule cellule. Ce système in vitro permet l’observation de milliers d’agrégats de taille variable en temps réel, en trois dimensions et à l’échelle du micron. Au niveau individuel et au niveau de la population, la capacité de regrouper les agrégats par phénotype et par position facilite l’observation des agrégats à différents stades de développement et leur réponse aux changements dans le microenvironnement, tels que le traitement antibiotique, à différencier avec précision.
Introduction
Pseudomonas aeruginosa (Pa) est un agent pathogène opportuniste qui établit des infections chroniques chez les personnes immunodéprimées. Pour les personnes atteintes de la maladie génétique de la fibrose kystique (FK), ces infections peuvent s’étendre sur toute une vie. La mucoviscidose provoque l’accumulation d’expectorations visqueuses et riches en nutriments dans les voies respiratoires, qui deviennent colonisées par une variété d’agents pathogènes microbiens au fil du temps. Le Pa est l’un des agents pathogènes les plus répandus de la FK, colonisant les voies respiratoires dans la petite enfance et établissant des infections difficiles à traiter1. L’AP demeure un problème clinique important et est considérée comme l’une des principales causes de mortalité chez les personnes atteintes de mucoviscidose, malgré l’amélioration des schémas thérapeutiques au cours des dernières années2,3. Ce phénotype persistance et l’augmentation de la tolérance aux antibiotiques ont valu à Pa une place dans un groupe d’agents pathogènes identifiés par les Centers for Disease Control (CDC) et l’Organisation mondiale de la santé (OMS) comme des priorités de recherche pour le développement de nouvelles stratégies thérapeutiques – les agents pathogènes ESKAPE4.
Comme d’autres agents pathogènes ESKAPE, la résistance aux antibiotiques acquise est courante dans le Pa,mais il existe également de nombreuses propriétés intrinsèques qui contribuent à la tolérance aux antimicrobiens du Pa. Parmi ceux-ci se trouve la capacité de Pa à former des agrégats-grappes très denses d’environ 10 à 1 000 cellules, qui peuvent être observées dans de multiples infections, y compris les expectorations des patients atteints de mucoviscidose5,6. Semblables à Pa étudiés dans d’autres systèmes de biofilm, les agrégats de Pa présentent des phénotypes cliniquement pertinents tels qu’une résistance accrue aux antibiotiques et l’activation de la communication cellule-cellule (quorum sensing (QS)). Par exemple, il a été démontré que les agrégats de Pa utilisent des comportements régulés par QS pour lutter contre d’autres microbes et tolèrent des traitements antimicrobiens tels que la production de pyocyanine7. La capacité d’étudier de tels comportements offre un aperçu passionnant des écosystèmes bactériens dans un environnement similaire à celui dans lequel ils existent dans le corps humain.
L’un des plus grands défis de l’étude de la façon dont les agrégats de Pa réagissent à l’environnement changeant des expectorations est le manque de systèmes pertinents et robustes sur le plan nutritionnel qui favorisent la formation d’agrégats. Une grande partie de ce que l’on sait sur le Pa a été découverte à l’aide de systèmes in vitro dans lesquels les cellules se développent planctoniquement ou dans une architecture caractéristique de « champignon » attachée à la surface qui n’a pas été observée in vivo8. Alors que les modèles classiques de croissance du biofilm, tels que les cellules d’écoulement ou la gélose solide, ont fourni des connaissances approfondies et précieuses sur les comportements bactériens et les mécanismes de tolérance aux antibiotiques, ces résultats ne se traduisent pas toujours in vivo. De nombreux modèles in vitro ont une capacité limitée à imiter l’environnement de croissance du site d’infection humaine, ce qui nécessite des études in vivo coûteuses. À leur tour, de nombreux modèles in vivo n’ont pas la flexibilité et la résolution offertes par les techniques in vitro.
Les expectorations synthétiques de fibrose kystique (SCFM2) sont conçues pour fournir un environnement de croissance de l’AP similaire à celui ressenti lors d’une infection chronique dans le poumon de la FK. SCFM2 comprend des sources nutritionnelles identifiées dans la sputa de FK expectorée en plus de la mucine, des lipides et de l’ADN. La croissance du Pa dans SCFM2 nécessite un ensemble de gènes presque identique à celui requis pour la croissance des expectorations réelles et soutient la formation naturelle d’agrégats de Pa 9,10. Après l’inoculation, les cellules planctoniques forment des agrégats dont la taille augmente par expansion. Les cellules individuelles (appelées migrants) sont libérées des agrégats, migrent vers des zones non colonisées et forment de nouveaux agrégats10. Cette histoire de vie peut être observée à l’aide de CLSM et de l’analyse d’images à la résolution d’une seule cellule. Les agrégats de Pa formés dans SCFM2 sont de tailles similaires à celles observées dans le poumon CF10. Ce modèle permet l’observation de multiples agrégats de taille variable en temps réel et en trois dimensions à l’échelle du micron. La microscopie en accéléré permet de suivre des milliers (~ 50 000) d’agrégats en une seule expérience. L’utilisation d’un logiciel d’analyse d’images permet de quantifier les phénotypes agrégés à partir de micrographies, y compris le volume agrégé, la surface et la position en trois dimensions au 0,1 μm le plus proche, à la fois au niveau de l’agrégat individuel et au niveau de la population. Avoir la capacité de regrouper les agrégats par phénotype et position permet la différenciation des agrégats à différents stades de développement avec précision, ainsi que leur réponse à un microenvironnement changeant6,11.
L’application de SCFM2 pour étudier les agrégats de Pa dans des essais à faible volume et à haut débit en fait un modèle flexible et rentable. En tant que milieu défini, SCFM2 offre uniformité et reproductibilité sur plusieurs plates-formes, fournissant une méthode nutritionnellement et physiquement pertinente pour étudier les agrégats de Pa de vitro9. Les applications incluent son utilisation en combinaison avec CLSM pour observer l’organisation spatiale et la tolérance aux antibiotiques à haute résolution (comme décrit dans ce document sur les méthodes). La capacité d’effectuer des expériences qui fournissent des données en temps réel à l’échelle du micron permet d’étudier les interactions intra-espèces et inter-espèces telles qu’elles peuvent se produire in vivo. Par exemple, SCFM2 a déjà été utilisé pour étudier la dynamique spatiale de la communication cellule-cellule dans des populations agrégées via un réseau de systèmes utilisés par Pa pour réguler plusieurs gènes qui contribuent à la virulence et à la pathogenèse6.
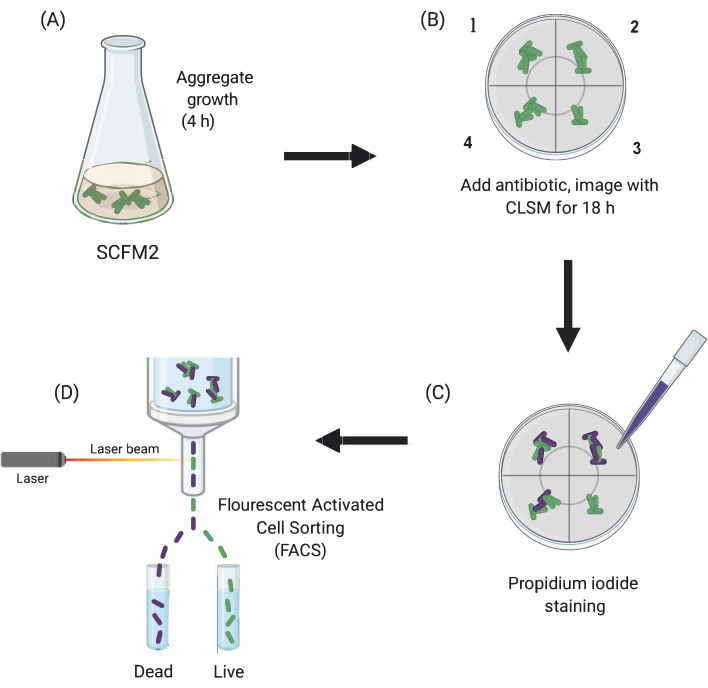
Figure 1: Représentation graphique des principales étapes expérimentales. (A) SCFM2 est inoculé avec des cellules Pa et autorisé à former des agrégats dans une boîte de culture à fond de verre. (B) Les agrégats sont transférés au microscope confocal et un antibiotique est ajouté. Trois répliques techniques (chambres 1 à 3) et un puits de contrôle (4) de SCFM2 inoculé sans traitement antibiotique sont représentés. Les agrégats sont imagés à l’aide de CLSM au cours de 18 h. (C) Après l’imagerie initiale de 18 heures, les agrégats sont traités avec de l’iodure de propidium pour visualiser les cellules mortes et imagés à l’aide de CLSM (D) Les agrégats avec le phénotype souhaité sont séparés de SCFM2 à l’aide de FACS. Abréviations : SCFM2 = milieu d’expectorations synthétiques de fibrose kystique; Pa = Pseudomonas aeruginosa; CLSM = microscopie confocale à balayage laser; FACS = tri cellulaire activé par fluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ici, l’utilité de SCFM2 pour étudier l’impact du traitement antibiotique sur les agrégats pa en temps réel est démontrée, suivie de l’utilisation d’une approche de tri cellulaire pour isoler des populations d’agrégats avec des phénotypes distincts pour une analyse en aval(Figure 1).
Protocol
Representative Results
Discussion
Ce travail a introduit des méthodologies qui peuvent être combinées pour étudier les populations bactériennes agrégées en présence et en l’absence de traitement antibiotique. Le CLSM haute résolution permet de visualiser les changements dans la biomasse agrégée et l’orientation structurelle des agrégats en temps réel lorsqu’ils sont exposés à des antibiotiques. En outre, les caractéristiques physiques et structurelles de la biomasse qui restent après le traitement avec des antibiotiques peuvent êt…
Divulgations
The authors have nothing to disclose.
Acknowledgements
S.E.D est soutenu par des fonds de démarrage fournis par le Département de médecine moléculaire, l’Université de Floride du Sud, ainsi que par une subvention de recherche CFF (DARCH19G0), le N.I.H (5R21AI147654 – 02 (PI, Chen)) et l’USF Institute on Microbiomes. Nous remercions le laboratoire Whiteley pour sa collaboration continue impliquant des ensembles de données liés à ce manuscrit. Nous remercions le Dr Charles Szekeres d’avoir facilité le tri FACS. Les figures ont été créées par A.D.G et S.E.D à l’aide de Biorender.com.
Materials
| Amino acids | |||
| Alanine | Acr s Organics s Organics |
56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acr s Organics s Organics |
56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acr s Organics s Organics |
138-15-8 | |
| Glycine | Acr s Organics s Organics |
56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acr s Organics s Organics |
73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acr s Organics s Organics |
63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acr s Organics s Organics |
63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acr s Organics s Organics |
72-19-5 | |
| Tryptophan | Acr s Organics s Organics |
73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acr s Organics s Organics |
72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acr s Organics s Organics |
7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acr s Organics s Organics |
7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acr s Organics s Organics |
7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acr s Organics s Organics |
12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNAse/DNAse free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
References
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O’Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573 (2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913 (2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240 (2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).

