Diffusion Tensor imagerie par résonance magnétique dans l'analyse des maladies neurodégénératives
Summary
Tenseur de diffusion d'imagerie (DTI) sert essentiellement comme un outil basé sur l'IRM pour identifier<em> In vivo</em> La microstructure du cerveau et des processus pathologiques dus à des troubles neurologiques, à l'intérieur de la matière blanche cérébrale. DTI analyses basées permettent une application pour les maladies du cerveau, tant au niveau du groupe et des données à sujet unique.
Abstract
Techniques d'imagerie du tenseur de diffusion (DTI) fournissent des informations sur les processus de microstructure de la matière blanche cérébrale (WM) in vivo. Les applications actuelles sont conçues pour étudier les différences de modes de participation MW dans différentes maladies du cerveau, troubles neurodégénératifs, notamment par l'utilisation de différentes analyses DTI par rapport à des témoins appariés.
L'analyse des données DTI est effectué de façon variable aléatoire, ie comparaison voxelwise de paramètres régionaux de diffusion direction basés tels que l'anisotropie fractionnelle (FA), ainsi que le suivi de la fibre (FT) accompagné de statistiques anisotropie fractionnelle tractwise (AGT) au niveau du groupe afin d'identifier les différences FA long structures WM, visant à la définition de schémas régionaux d'altérations WM au niveau du groupe. Transformation en un espace standard stéréotaxique est une condition préalable pour des études de groupe et nécessite des données approfondies traitement afin de préserver dinterdépendances irectional. Les applications actuelles montrent approches techniques optimisées pour cette préservation de l'information quantitative et directionnel lors de la normalisation spatiale dans l'analyse des données au niveau du groupe. Sur cette base, les techniques de FT peuvent être appliquées à des données moyennes de groupe afin de quantifier des informations métriques telles que définies par FT. En outre, l'application de méthodes DTI, à savoir les différences de FA-cartes après alignement stéréotaxique, dans une analyse longitudinale sur la base d'un sujet individuel révéler des informations sur la progression des troubles neurologiques. Amélioration de la qualité ultérieure des résultats de base DTI peut être obtenue lors du prétraitement par application d'une élimination contrôlée des directions de gradient avec des niveaux de bruit élevés.
En résumé, DTI est utilisé pour définir un pathoanatomy WM distinct de différentes maladies du cerveau par la combinaison de l'ensemble de l'analyse DTI fondée sur le cerveau et les voies basée.
Introduction
l'imagerie du tenseur de diffusion dans le cerveau humain
Les matières étendues blanches (WM) dans le système nerveux central se composent des axones denses, en plus de divers types de neuroglia et d'autres petites populations de cellules. La membrane axonale ainsi que les fibres protéiques bien aligné à l'intérieur d'un axone restreint la diffusion de l'eau perpendiculairement à l'orientation des fibres, ce qui conduit à la diffusion de l'eau dans le cerveau anisotrope WM 1. Gaines de myéline autour des axones peuvent également contribuer à l'anisotropie pour l'eau intra-et extracellulaire 2.
La description quantitative de cette anisotropie peut être détectée par l'imagerie du tenseur de diffusion (DTI). DTI produit des images de tissus pondérés avec les caractéristiques des microstructures locales de diffusion de l'eau. Les images-intensité à chaque position sont atténués, en fonction de la force et la direction du gradient dite diffusion magnétique (représenté enla valeur de b), ainsi que sur la microstructure locale dans laquelle les molécules d'eau diffusent 3, le coefficient de diffusion D, une valeur scalaire:
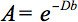
Toutefois, en présence d'anisotropie dans WM, la diffusion ne peut plus être caractérisé par un coefficient scalaire, mais nécessite un tenseur  qui en première approximation décrit mobilité moléculaire le long de chaque direction et la corrélation entre ces directions 4. anisotropie de diffusion est principalement causée par l'orientation des faisceaux de fibres dans WM et est influencé par ses micro-et macro-structurale fonctionnalités. Parmi les caractéristiques de microstructure, l'organisation intra-axonal semble être de la plus grande influence sur l'anisotropie de diffusion, en plus de la densité de fibres pargarnissage de cellule ème, le degré de myélinisation, et le diamètre de fibre individuelle. Sur une échelle macroscopique, la variabilité dans l'orientation de toutes les voies WM dans une imagerie voxel influence son degré d'anisotropie 5.
qui en première approximation décrit mobilité moléculaire le long de chaque direction et la corrélation entre ces directions 4. anisotropie de diffusion est principalement causée par l'orientation des faisceaux de fibres dans WM et est influencé par ses micro-et macro-structurale fonctionnalités. Parmi les caractéristiques de microstructure, l'organisation intra-axonal semble être de la plus grande influence sur l'anisotropie de diffusion, en plus de la densité de fibres pargarnissage de cellule ème, le degré de myélinisation, et le diamètre de fibre individuelle. Sur une échelle macroscopique, la variabilité dans l'orientation de toutes les voies WM dans une imagerie voxel influence son degré d'anisotropie 5.
Dans les mesures typiques DTI, les dimensions de voxel sont de l'ordre de quelques millimètres. Ainsi, un voxel contient toujours l'information moyennée des molécules d'eau à l'intérieur du volume saisi qui couvre habituellement plusieurs axones ainsi que les molécules d'eau environnantes. Malgré cet environnement multidirectionnel, DTI est sensible à l'orientation du grand axe principal, qui est aligné à la direction axonale prédominant, soit la contribution axonale domine le signal de mesure 2.
DTI fournit deux types d'informations sur la propriété de diffusion de l'eau: d'abord, la mesure orientation indépendant de diffusion anisotropie 5 et la deuxième, la direction prédominante de diffusion de l'eau dans image voxels, à savoir l'orientation de la diffusion 6.
Les protocoles actuels sont censés fournir un cadre de techniques d'analyse du DTI pour la comparaison quantitative des groupes thématiques au niveau du groupe, tel que décrit ci-après.
Quantification des propriétés de diffusion – paramètres d'analyse
Les éléments du tenseur symétrique peuvent être mesurés par des gradients de diffusion long d'au moins six non-alignés et non coplanaires directions de sorte que b (équation 1) est devenu un tenseur, ce qui entraîne l'atténuation du signal
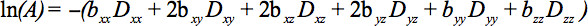
Cette équation nécessite la comptabilisation des interactions possibles entre l'imagerie et de gradients de diffusion qui sont appliquées dans des directions orthogonales (termes croisés) et même entre les gradients d'imagerie qui sont appliquéesdans des directions orthogonales 4.
Le tenseur de diffusion de second rang  on peut toujours diagonaliser ne laissant que trois éléments non nuls long de la diagonale principale du tenseur, c'est à dire les valeurs propres (
on peut toujours diagonaliser ne laissant que trois éléments non nuls long de la diagonale principale du tenseur, c'est à dire les valeurs propres ( 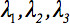 ). Les valeurs propres reflètent la forme ou la configuration de l'ellipsoïde. La relation mathématique entre les coordonnées du principal de l'ellipsoïde et le châssis laboratoire est décrit par les vecteurs propres
). Les valeurs propres reflètent la forme ou la configuration de l'ellipsoïde. La relation mathématique entre les coordonnées du principal de l'ellipsoïde et le châssis laboratoire est décrit par les vecteurs propres 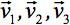
Comme il ya plusieurs défis dans l'affichage des données tenseur, le concept d'ellipsoïdes de diffusion a été proposé 3. Les Eigendiffusivities de ces ellipsoids représentent les coefficients de diffusion unidimensionnels dans la direction principale de la diffusivité du milieu, à savoir l'axe principal de l'ellipsoïde représente la direction de diffusion principale du voxel qui coïncide avec la direction des fibres, tandis que l'excentricité de l'ellipsoïde fournit des informations sur l' degré d'anisotropie et sa symétrie. Par conséquent, les mesures d'anisotropie de diffusion tels que l'anisotropie fractionnelle (FA) pourraient être définies 7.
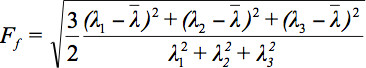
 est la moyenne arithmétique de toutes les valeurs propres.
est la moyenne arithmétique de toutes les valeurs propres.
Une autre approche consiste à utiliser la direction principale du tenseur de diffusion pour aborder la connectivité WM du cerveau, ce qui correspond à la tractography approach qui a l'intention d'enquêter sur quelles parties du cerveau sont reliés les uns aux autres. En supposant que l'orientation de la composante majeure du tenseur de diffusion représente l'orientation des voies axonales dominantes, un champ de vecteurs 3-D est prévue, dans laquelle chaque vecteur représente l'orientation des fibres. Actuellement, il existe plusieurs approches différentes pour reconstruire tracts MW qui pourrait être divisé en deux catégories: la première catégorie est basée sur des algorithmes de propagation de la ligne en utilisant les informations de tenseur local pour chaque étape de la voie de propagation de la fibre 2,8,9. La deuxième catégorie est basée sur la minimisation de l'énergie mondiale pour trouver le chemin énergétiquement plus favorable entre deux régions WM, résultant dans l'approche des statistiques spatiales voies basées sur (TBSS) 10 qui a été utilisé dans d'autres algorithmes comme les statistiques de anisotropie fractionnelle tractwise (AGT – voir texte du protocole, section 2.4)..
Transformation en position stéréotaxiqueard espace
Comme dans d'autres méthodes avancées de l'IRM, DTI et études FT-base dans un contexte clinique de poursuivre l'objectif ultime de classer la morphologie du cerveau de chaque patient afin de faciliter le processus de diagnostic basé sur une certaine discrimination métrique 11. Les études au niveau du groupe sont les plus pertinentes si le phénotype clinique commun est censé être en raison de dommages à une ou plusieurs zones spécifiques du cerveau ou d'un réseau neuroanatomiques spécifiques. Ici, la moyenne des résultats pour les différents sujets est utile pour évaluer les caractéristiques communes de changements de microstructure. Chaque cerveau individuel doit être transférée dans l'espace stéréotaxique de sorte que, dans une deuxième étape, la moyenne arithmétique des résultats à un niveau de voxel par voxel est possible. Normalisation spatiale a permis de moyenne arithmétique des résultats obtenus à partir de différentes matières, afin d'améliorer le rapport signal-sur-bruit (SNR) et pour effectuer une comparaison entre des échantillons de patients et contRols afin d'analyser la pathoanatomy calcul d'un trouble spécifique, par exemple une maladie neurodégénérative qui est associée à l'affectation d'un système spécifique du cerveau.
La première approche de la normalisation à un espace stéréotaxique standard de 12 a proposé un algorithme de transformation d'un atlas standard impliquant l'identification des différents sites du cerveau et fragmentaire échelle des quadrants du cerveau. Aujourd'hui, la plupart des logiciels d'analyse de données avancées d'IRM utilisent la normalisation de l'Institut neurologique de Montréal (INM) de l'espace stéréotaxique 13. Pour cette transformation, les algorithmes d'enregistrement cerveau semi-automatiques et automatiques à l'aide de modèles spécifiques de l'étude ont été élaborés 14,15. En DTI, une attention particulière doit être établi afin de préserver l'information de la direction pendant le processus de normalisation 16,17. L'application de transformations spatiales aux images DT-MR qui sont nécessaires pour la normalisation spatialedes collections d'ensembles de données est, contrairement aux images scalaires de déformation, compliqué par le fait que DTS ne contiennent pas d'informations d'orientation qui est à nouveau affectée par la transformation. Cet effet doit être pris en compte afin d'assurer l'exactitude anatomique de l'image transformée. Ici, les techniques d'application de transformations affines pour les ensembles de données DTI sont présentés.
Application de la DTI pour les maladies du cerveau
La comparaison des données longitudinales DTI nécessite un alignement / enregistrement des données d'un sujet parmi d'autre. Dans ce contexte, la préservation de l'information directionnelle est nécessaire (par exemple rotation du tenseur de diffusion pendant les transformations affines). Les applications possibles de maladies neurodégénératives ont été rapportés précédemment (par exemple 18,19).
DTI a été établi comme un outil technique non-invasive robuste pour étudier in vivo Neuropatholgie de WM voies neuronales (par exemple 11,20,21,22). Mesures quantitatives DTI à base du processus de diffusion, par exemple la FA, ont déjà été présentés comme des marqueurs sensibles pour étudier un large éventail de pathologies WM, comme un AVC 20, la sclérose en plaques 23, la sclérose latérale amyotrophique 24, 25, de la maladie d'Alzheimer 26 , et plusieurs autres troubles WM 27,28.
En outre, le DTI avec FT peut être utilisé pour identifier les voies WM 23. Cette technique, alors que pas encore en utilisation clinique de routine, est en train de devenir un instrument puissant pour l'évaluation des anomalies voie spécifiques à une maladie neurologique. Dans les parcelles identifiées, divers indices IRM quantitatives dérivées de DTI et acquisitions supplémentaires (par exemple des images pondérées en T2 et / ou transfert de magnétisation (MT) Imagerie) qui sont anatomiquement recalées aux données DTI pourraient être mesurés. Par la présente, chaque indice pourrait être calculATED en fonction de la position dans l'appareil, se référant à des parcelles représentant leur variation spatiale que les profils des voies.
Dans les scans, DTI humaines suivantes qui ont été effectuées sur 1,5 Tesla l'IRM scanners (Siemens Medical, Erlangen, Allemagne) ont été utilisés pour étudier le potentiel de différentes techniques d'analyse pour la détection des anomalies de la substance blanche dans les groupes de patients ainsi que chez les individus. Après une vérification automatisée de la qualité pour l'élimination des volumes mouvement corrompus et les volumes avec d'autres types d'artefacts, des procédures de post-traitement standardisés préparer les données DTI pour l'analyse consécutive. Différentes approches d'analyse seront illustrés dans ce qui suit, à savoir d'abord, tout le cerveau en fonction des statistiques spatiales (WBSS), deuxième, FT, et troisièmement, les statistiques de l'anisotropie fractionnelle Tractwise (AGT). WBSS est une méthode qui fonctionne de manière analogue à la morphométrie voxel (VBM) qui est généralement connu comme morphometry / statistiques voxel sur les données DTI (VBM / DTI) <em>. VBM est une méthode qui fonctionne d'abord sur les images de contraste où les différences de contraste dans les analyses séparées doivent être résolues en WBSS est une méthode qui utilise la comparaison voxelwise d'un paramètre physique. Par conséquent, bien algorithme similaire, une terminologie qui différencie WBSS et VBM sera utilisé par la suite.
Protocol
Representative Results
Discussion
Inter-individuelle moyenne des données DTI peut être réalisé par rapport à l'amplitude de diffusion (par utilisation de l'information FA) et la direction de diffusion (en fonction de FT), respectivement. Étalement de la FA cartes permet la comparaison statistique des groupes de matières par WBSS et TFAS. Ce cadre méthodologique donne une introduction aux techniques DTI avec inter-sujet moyenne et la comparaison de groupe. Normalisation stéréotaxique et la comparaison des cartes FA au niveau du groupe p…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Certaines parties de ce travail, à savoir l'étude sur QC et correction des directions de gradient corrompus en application aux données des patients atteints de trouble hyperkinétique, ont été pris en charge par le réseau européen HD (EHDN projet 070). Les examens par IRM dans cette étude ont été certain acquises dans le cadre du site cohorte TRACK-HD Londres.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
Riferimenti
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

