Nörodejeneratif Hastalıkların Analizi Difüzyon Tensör Manyetik Rezonans Görüntüleme
Summary
MRI-tabanlı bir araç tespit olarak difüzyon tensör görüntüleme (DTG) temelde hizmet vermektedir<em> In vivo</em> Serebral beyaz cevher içinde nörolojik bozukluklar nedeniyle beyin ve patolojik süreçlerin mikro. DTI tabanlı analizler grup seviyesinde ve tek bir konu veri hem de beyin hastalıkları için uygulama için izin verir.
Abstract
Difüzyon tensör görüntüleme (DTG) teknikleri in vivo serebral beyaz cevher (WM) ve mikro süreçleri hakkında bilgi vermek. Mevcut uygulamalar uyumlu kontrollere göre farklı DTI analizler kullanılarak farklı beyin hastalıkları, özellikle nörodejeneratif hastalıkların, WM katılımı desen farklılıkları araştırmak için tasarlanmıştır.
DTI veri analizi bir değişken şekilde yapılır, birlikte lif izleme ile bu fraksiyonel anizotropi gibi bölgesel difüzyon yön-tabanlı ölçümleri (FA), (FT) yani voxelwise karşılaştırılması amacıyla grup seviyesinde tractwise fraksiyonel anizotropi istatistik (TFAS) ile birlikte grup seviyesinde WM değişikliklerin bölgesel desen tanımı amaçlayan, WM yapıları birlikte FA farklılıkları tanımlamak için. Bir stereotaksik standart uzaya Dönüşüm grup çalışmaları için bir ön koşuldur ve d korumak için işlem ayrıntılı veri gerektiririrectional arası bağımlılıkları. Mevcut uygulamalar grup seviyesinde veri analizleri mekansal normalleştirme sırasında nicel ve yön bu bilgi korunması için optimize edilmiş teknik yaklaşımlar göstermektedir. Bu temelde, MS teknikleri MS tarafından tanımlanan ölçüm bilgilerini ölçmek amacıyla grubun ortalama veri uygulanabilir. Ayrıca, DTI yöntemlerin uygulanması, bireysel konu bazında bir uzunlamasına analizinde stereotaksik yönlendirmeden sonra FA-haritalarda yani farklılıkları, nörolojik hastalıkların ilerlemesi hakkında bilgi ortaya koymaktadır. DTG tabanlı bir sonuç daha da kalitesinin iyileştirilmesi yüksek gürültü seviyeleri gradyanı ile yönde kontrollü bir eleme uygulanması ile ön işleme sırasında elde edilebilir.
Özet olarak, DTG tüm beyin bazlı ve kanal bazlı DTG analizi kombinasyonu, farklı beyin hastalıkları ayrı bir WM pathoanatomy tanımlamak için kullanılır.
Introduction
Insan beyninde difüzyon tensör görüntüleme
Merkezi sinir sisteminde beyaz madde (PY) nöroglia yolları ve diğer hücre nüfusu az çeşitli ek olarak yoğun bir şekilde aksonlar oluşur. Bir akson olan aksonal membran hem de iyi hizalanmış protein lifleri beyin WM 1 anizotropik su dağılım yol açan, lif yönelimine dik su dağılım kısıtlar. Aksonlar etrafında miyelin kılıfını da hücre içi ve dışı su 2 her ikisi için de anizotropi katkıda bulunabilir.
Bu anizotropi kantitatif açıklaması difüzyon tensör görüntüleme (DTG) tarafından tespit edilebilir. DTI su difüzyon yerel mikro özelliklere sahip ağırlıklı dokuların görüntüler üretir. Her pozisyonda görüntü yoğunlukları (temsil sözde difüzyon manyetik gradyan şiddeti ve yönü ile ilgili olarak, zayıflatılmışb-değeri), hem de su molekülleri 3 yaygın olan, yerel mikro, difüzyon katsayısı D skalar değeri:
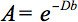
Bununla birlikte, WM anizotropi varlığında, difüzyon artık tek bir skalar katsayısı ile karakterize edilen, ancak tensör gerektirir  İlk yaklaşım bu yönde 4 arasında her yönde ve korelasyon birlikte moleküler hareketlilik anlatılmaktadır. Difüzyon anizotropi özellikle WM lif yolları yönünü neden olur ve mikro-ve macrostructural özellikleri etkilenir. Mikroyapısal özellikleri arasında, intraaxonal organizasyon lif yoğunluğunun yanı sıra, difüzyon anizotropi üzerinde büyük etkisi olduğu görülmektedirnd hücre ambalaj, miyelinasyonun derecesi ve bireysel elyaf çapı. Bir makroskopik ölçekte, bir görüntüleme voksel tüm WM yolları yönde değişkenlik anizotropi 5 derecesi etkiler.
İlk yaklaşım bu yönde 4 arasında her yönde ve korelasyon birlikte moleküler hareketlilik anlatılmaktadır. Difüzyon anizotropi özellikle WM lif yolları yönünü neden olur ve mikro-ve macrostructural özellikleri etkilenir. Mikroyapısal özellikleri arasında, intraaxonal organizasyon lif yoğunluğunun yanı sıra, difüzyon anizotropi üzerinde büyük etkisi olduğu görülmektedirnd hücre ambalaj, miyelinasyonun derecesi ve bireysel elyaf çapı. Bir makroskopik ölçekte, bir görüntüleme voksel tüm WM yolları yönde değişkenlik anizotropi 5 derecesi etkiler.
Tipik DTI ölçümlerde, voksel boyutları milimetre sıralanmıştır. Bu nedenle, her bir voksel genellikle birkaç akson hem de çevresindeki su molekülleri kapsar tespit hacmi içindeki su moleküllerinin ortalama bilgi içerir. Bu çok yönlü ortama rağmen, DTI baskın aksonal yönüne hizalar en büyük ana ekseni yönünü duyarlı, yani aksonal katkı ölçülen sinyal 2 hakimdir.
İlk, difüzyon anizotropi 5 ve ikinci yönünü bağımsız ölçüde, imag su difüzyon baskın yönü: DTI su difüzyon özelliği hakkında iki tür bilgi sağlare vokselleri, difüzyon dizilişi 6 yani.
Aşağıdaki belirtildiği gibi mevcut protokoller, grup seviyesinde konu grupları kantitatif karşılaştırılması için DTI analiz teknikleri bir çerçeve sağlamak gerekiyor.
Difüzyon özelliklerinin ölçümü – analiz parametreleri
B (Denklem 1) Bir tensör olmuştur, böylece simetrik tensörünün elemanları sinyal kaybı ile sonuçlanan, en az altı olmayan doğrudaş ve eş düzlemli olmayan yönleri boyunca difüzyon gradyanlar ile ölçülebilir
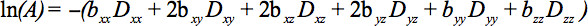
Bu denklem dik yönde (çapraz açısından) uygulanan ve hatta uygulanan görüntüleme geçişlerini arasında olan görüntüleme ve difüzyon geçişlerini arasındaki olası etkileşimler için muhasebe gerektirirdik yönde 4.
İkinci-sıra difüzyon tensör  her zaman tensör temel diyagonal boyunca sadece üç sıfır olmayan elemanlar terk köşegenleştirilebilir olabilir, (Özdeğer yani
her zaman tensör temel diyagonal boyunca sadece üç sıfır olmayan elemanlar terk köşegenleştirilebilir olabilir, (Özdeğer yani 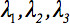 .) Özdeğer elipsoid şekli veya yapılandırma yansıtmaktadır. Elipsoid ve laboratuvar çerçevenin koordinatlar arasındaki matematiksel ilişki özvektörler tarafından açıklanan
.) Özdeğer elipsoid şekli veya yapılandırma yansıtmaktadır. Elipsoid ve laboratuvar çerçevenin koordinatlar arasındaki matematiksel ilişki özvektörler tarafından açıklanan 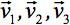
Tensör veri görüntüleme çeşitli zorluklar olduğu için, difüzyon elipsoitlerin kavramı 3 önerilmiştir. Bu e EigendiffusivitiesElipsoid eksantrikliği ile ilgili bilgi sağlar iken elipsoidin ana ekseni, liflerin yönü ile çakışan voksel temel yayılma yönü temsil llipsoids yani, ortamın difüzyon ana yönde tek boyutlu difüzyon katsayıları temsil anizotropi ve simetri derecesi. Bu nedenle, fraksiyonel anizotropi (FA) olarak difüzyon anizotropi ölçümleri 7 tanımlanabilir.
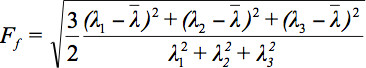
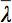 Tüm Özdeğer ve aritmetik ortalamasıdır.
Tüm Özdeğer ve aritmetik ortalamasıdır.
Bir başka yaklaşım traktografi approa tekabül eden, beynin WM bağlantı adresine difüzyon tensörünün ana yön kullanmaktırhangi kanal birbirine bağlı olduğu, beynin bölümleri araştırmak için niyeti. Difüzyon tensör en önemli bileşeni yönünü baskın aksonal yolları yönünü temsil ettiği varsayılarak, her vektör fiber yönü temsil eder, bir 3-D vektör alanı sağlanır. İlk kategori fiber yolu yayılma 2,8,9 her adımı için yerel tensör bilgileri kullanarak hat yayılma algoritmalar dayanmaktadır: Şu anda, iki tip ayrılabilir olabilir WM yolları yeniden inşa etmek farklı yaklaşımlar vardır. İkinci kategori yolu tabanlı mekansal istatistik yaklaşımı ile sonuçlanan iki WM bölge arasındaki enerjik en uygun yolu bulmak için küresel enerji minimizasyonu dayanmaktadır (TBSS) gibi tractwise fraksiyonel anizotropi istatistik (TFAS gibi diğer algoritmalar kullanılmıştır 10 – protokol metni, bkz. Bölüm 2.4)..
Stereotaksik standı dönüşümard alanı
Diğer gelişmiş MR yöntemleri gibi, bir klinik bağlamda DTI-ve FT-dayalı çalışmalar 11 metrik bazı ayrımcılığa dayalı tanı sürecini kolaylaştırmak için hastanın beyin morfolojisi kategorize nihai hedefi takip. Ortak klinik fenotip bir veya daha fazla beyin alanları veya belirli nöroanatomik ağa hasar nedeniyle olması gerekiyordu, grubun düzeyinde çalışmalar en uygun olan. Burada, farklı konular için sonuçların ortalama mikro değişiklikler ortak kalıpları değerlendirmek için yararlıdır. Her bir beyin, böylece bir ikinci adımda, ortalama aritmetik bir voksel-by-voksel düzeyde sonuç mümkündür stereotaksik uzaya aktarılır zorundadır. Mekansal normalleştirme sinyal-gürültü oranı (SNR) geliştirmek ve hasta numuneleri ve konteynerler bir karşılaştırma yapmak amacıyla farklı hastalardan elde edilen sonuçların aritmetik ortalama müsadeRols belirli bir bozukluğun hesaplama pathoanatomy analiz etmek için, belirli bir beyin sisteminin özenti ile ilişkili bir nörodejeneratif hastalık gibi.
12 tarafından standart bir stereotaksik alana normalleştirme erken yaklaşımı çeşitli beyin yerler ve beyin kadranın parça parça ölçekleme belirlenmesi içeren standart bir atlas bir dönüşüm algoritması önerdi. Günümüzde, gelişmiş MR veri analizi paketleri çoğu Montreal Nöroloji Enstitüsü (MNI) stereotaksik alanı 13 normalleştirme kullanın. Bu dönüşüm için, çalışma belirli şablonları kullanarak yarı otomatik ve otomatik beyin kaydı algoritmaları 14,15 geliştirilmiştir. DTI, özel ilgi normalleşme sürecine 16,17 sırasında yön bilgilerini korumak için çizilecek vardır. DT-MR görüntüleri için mekansal dönüşümlerin uygulanması hangi mekansal normalleşmesi için gereklidirveri setleri koleksiyonları DTS yeniden dönüşümü ile etkilenir yönelim bilgisi içeren gerçeği ile daha da karmaşık çözgü sayısal görsel aksine vardır. Bu etki dönüştürülmüş görüntünün anatomik doğruluğunu sağlamak için dikkate alınması gerekir. Burada, DTI veri setleri için afin dönüşümler uygulamak için teknikleri sunulmaktadır.
Beyin hastalıkları DTI Uygulanması
Uzunlamasına DTI veri karşılaştırılması aralarında bir konu veri bir uyum / kayıt olunması. Bu bağlamda, yön bilgilerin korunması (afin dönüşümler sırasında difüzyon tensör yani dönme) gereklidir. Nörodejeneratif hastalıklar için olası uygulamalar (örneğin 18,19) daha önce bildirilmiştir.
DTI in vivo nöropatoloji araştırmak için güçlü bir non-invaziv teknik araç olarak kurulmuşturWM nöronal yolları ogy (örneğin 11,20,21,22). Difüzyon süreci DTG tabanlı bir miktar ölçümleri, FA, örneğin daha önce, inme 20, multipl skleroz 23, amiyotrofik lateral skleroz, 24, 25, Alzheimer hastalığı 26 olarak WM patolojilerin, geniş bir yelpazede çalışmak için hassas belirteçleri gösterilmiştir ve diğer bazı WM bozuklukları 27,28.
Buna ek olarak, FT ile DTG WM yolları 23 tanımlamak için kullanılabilir. Bu teknik, hala rutin klinik kullanımda, nörolojik hastalığı yolu özgü anormalliklerin değerlendirilmesi için güçlü bir araç olarak ortaya çıkmaktadır olmasa da. Tespit yolları içinde, çeşitli kantitatif MRG endeksleri DTI verilere anatomik coregistered olan ölçülebilir ki DTI ve ek satın alma (örneğin, T2 ağırlıklı görüntülerde ve / veya manyetizasyon transfer (MT) görüntüleme) elde edilen. Bu vesile ile, her dizin calcul olabilirsistem profilleri olarak mekansal değişim gösteren araziler atıfta sistemi içinde konumunun bir fonksiyonu olarak ated.
1.5 uygulandı aşağıdaki, insan DTI taramaları Tesla MR-tarayıcılar (Siemens Medical, Erlangen, Almanya) hasta gruplarında hem de bireylerde beyaz cevher anormallikleri tespit etmek için çeşitli analiz tekniklerinin potansiyel araştırmak için kullanılmıştır. Eserler başka türlü hareket bozuk hacimleri ve hacimleri ortadan kaldırılması için otomatik bir kalite kontrol sonra, standart postprocessing işlemleri ardışık analiz için DTI verileri hazırlamak. Farklı analiz yaklaşımlar aşağıdaki gösterildiği, yani mekansal istatistik tabanlı ilk, tüm beyin (WBSS), ikinci, FT, ve üçüncü, Tractwise fraksiyonel anizotropi istatistik (TFAS). Olacak WBSS genellikle DTI verileri (VBM / DTI) üzerinde voksel tabanlı morfometri / istatistik olarak bilinir voksel tabanlı morfometri (VBM) benzer şekilde çalışan bir yöntemdir <em>. VBTM başlangıçta WBSS bir fiziksel parametrenin voxelwise karşılaştırması kullanan bir yöntem ise ayrı olarak tarar kontrast farklılıkları çözülmesi gereken kontrast görüntüleri üzerinde çalışan bir yöntemdir. Algoritmik benzer olsa da, bu nedenle, WBSS ve VBM ayırt bir terminoloji aşağıdaki kullanılacaktır.
Protocol
Representative Results
Discussion
DTG veri denekler arası ortalama sırasıyla difüzyon genliği (FA bilgilerin kullanılması ile) ve yayılma yönü (FT dayalı olarak) ile ilgili olarak elde edilebilir. FA haritaların ortalama WBSS ve TFAS tarafından konu grupların istatistiksel karşılaştırma için izin verir. Bu metodolojik çerçeve arası konu ortalama ve grup karşılaştırma ile DTI tekniklerine giriş yapılıyor. Stereotaksik normalleştirme ve grup düzeyinde FA haritaların karşılaştırılması konu grupları arasındaki farklı…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu çalışmanın parçaları, QC ve hiperkinetik bozukluğu olan hastaların verilerine uygulamada bozuk gradyan yönleri için düzeltme üzerinde çalışma yani Avrupa HD ağ (EHDN projesi 070) tarafından desteklenmiştir. Bu belirli çalışmada MRI taramaları Londra sitesi TRACK-HD kohort bir parçası olarak satın alındı.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
Riferimenti
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

