神経変性疾患の分析における拡散テンソル磁気共鳴画像
Summary
拡散テンソル画像(DTI)は、基本的に識別するためのMRIベースのツールとして機能します<em生体内で></em>大脳白質内の神経疾患に起因する脳と病理学的プロセスの微細構造。 DTIベースの分析では、グループレベルで、単一の対象データの両方の脳疾患への応用を可能にします。
Abstract
拡散テンソル画像(DTI)の技術は、生体内で大脳白質(WM)の微細構造のプロセスに関する情報を提供します。本アプリケーションは、マッチさせた対照と比較して異なるDTI解析を用いて、異なる脳疾患、特に神経変性疾患に関与WMのパターンの相違を調査するために設計されている。
DTIデータ分析は変量の方法で行われ、一緒に線維追跡でそのような異方性比率(FA)などの地域の拡散方向ベースのメトリックすなわち voxelwise比較、(FT)は、順番にグループレベルでtractwise異方性比率の統計(TFAS)を伴うグループレベルでWMの変化の地域的パターンの定義を目指し、WM構造に沿ってFAの違いを識別します。定位標準空間への変換は、グループ研究のための前提条件であり、dを保持するために徹底した処理データが必要irectional相互依存。現在のアプリケーションでは、グループレベルでのデータ分析における空間正規化中に定量的および方向情報の保存のための最適化されたこの技術的なアプローチを示しています。これに基づいて、FT技術はFTによって定義されたメトリック情報を定量化するために、グループ平均化データに適用することができる。さらに、DTIの方法の適用は、個々の対象者ごとに縦分析における定位整列後のFA-マップすなわち違いは、神経疾患の進行についての情報を明らかにする。 DTIベースの検索結果の更なる品質改善、高いノイズレベル勾配方向の制御された除去を適用することによって前処理中に得ることができる。
要約すると、DTIは、脳全体をベースと管系DTI分析の組み合わせによって異なる脳疾患の別個のWMの病理解剖学を定義するために使用される。
Introduction
人間の脳内の拡散テンソルイメージング
中枢神経系の白質(WM)管は、神経膠細胞の他の小集団の様々なタイプに加え、密集軸索から構成されています。軸索内の軸索の膜と同様によく整列蛋白繊維は脳WM 1における異方性の水の拡散につながる、繊維配向に水拡散垂直に制限されます。軸索の周りに髄鞘はまた、内と外の両方の水2用異方性に寄与する可能性がある。
この異方性の定量的な記述は、拡散テンソルイメージング(DTI)によって検出される可能性がある。 DTIは、水の拡散の局所微細構造の特性で重み付け組織の画像を生成する。各位置における画像強度は、で表され、いわゆる磁気拡散勾配(の強さと方向に応じて、減衰されるb値)、ならびに水分子3を拡散する局所微細構造、拡散係数D、スカラー値に関する:
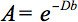
しかし、WMに異方性の存在下で、拡散はもはや単一のスカラー係数によって特徴付けないが、テンソルを必要とすることができる 第一近似でこれらの方向4との間の各方向と相関関係に沿って分子運動を記述する。拡散異方性は、主にWM路における繊維の配向によって引き起こされ、そのミクロおよびマクロ構造の特徴によって左右される。微細構造の特徴のうち、intraaxonal組織は、繊維の密度の他に、拡散異方性に最も大きな影響があるように見えるNDセルパッキング、髄鞘形成の程度、および個々の繊維径。巨視的スケールでは、イメージングボクセル内のすべてのWMの管の向きの変動が異方性5の程度に影響を与えます。
第一近似でこれらの方向4との間の各方向と相関関係に沿って分子運動を記述する。拡散異方性は、主にWM路における繊維の配向によって引き起こされ、そのミクロおよびマクロ構造の特徴によって左右される。微細構造の特徴のうち、intraaxonal組織は、繊維の密度の他に、拡散異方性に最も大きな影響があるように見えるNDセルパッキング、髄鞘形成の程度、および個々の繊維径。巨視的スケールでは、イメージングボクセル内のすべてのWMの管の向きの変動が異方性5の程度に影響を与えます。
典型的なDTIの測定では、ボクセル寸法はミリメートルの順になっています。したがって、ボクセルは常に通常、複数の軸索と同様、周囲の水分子をカバーする検出ボリューム内の水分子の平均情報が含まれています。この多方向環境にもかかわらず、DTIが優勢軸索の方向に揃え最大主軸の向きに敏感であり、 すなわち軸索の貢献は、測定信号2を支配する。
まず、拡散異方性5と第2の向きに依存しない程度、IMAGの水拡散の優勢な方向:DTIは、水の拡散のプロパティに関する2種類の情報を提供しています電子ボクセルは、拡散方向6、すなわち 。
以下に概説されるように現在のプロトコルは、グループレベルで被写体基の定量的比較のためにDTI分析技術のフレームワークを提供することになっている。
拡散特性の定量化-分析パラメータ
B( 式1)テンソルとなっているように、対称テンソルの要素は、信号減衰をもたらす、少なくとも6つの非共線および非同一平面上の方向に沿って拡散勾配によって測定することができる
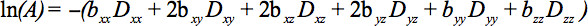
この方程式は、直交する方向(交差項)に適用しても適用されているイメージング勾配との間でされているイメージングと拡散勾配の間の相互作用の可能性に関する会計処理を必要とする直交する方向に4。
第二ランクの拡散テンソル 常にテンソルの主対角線に沿って3つだけの非ゼロの要素を残して対角化することができ、(固有値、すなわち
常にテンソルの主対角線に沿って3つだけの非ゼロの要素を残して対角化することができ、(固有値、すなわち 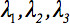 )。固有値は、楕円体の形状や構成を反映。楕円や実験枠の主座標との間の数学的関係は、固有ベクトルにより記載されている
)。固有値は、楕円体の形状や構成を反映。楕円や実験枠の主座標との間の数学的関係は、固有ベクトルにより記載されている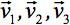
テンソルデータを表示する際にいくつかの課題があるため、拡散楕円体の概念は3提案されている。これらの電子のEigendiffusivities楕円体の離心率についての情報を提供しながら、楕円の主軸は、繊維の方向と一致するボクセルの主要な拡散方向を示し、すなわち llipsoidsは、媒体の拡散係数の主方向の一次元拡散係数を表す異方性とその対称性の度合い。したがって、このような異方性比率(FA)などの拡散異方性のメトリックは、7を定義することができる。
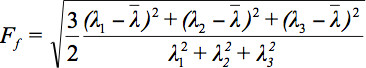
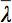 すべての固有値の算術平均です。
すべての固有値の算術平均です。
さらなるアプローチは、ラクトapproaに対応する、脳のWMの接続に対処するために、拡散テンソルの主方向を使用することであるそのchが互いに接続されている脳の部分検討する意思を有している。拡散テンソルの主成分の方向が支配的な軸索路の向きを表すと仮定すると、各ベクトルは、繊維配向を表す、3次元ベクトル場が設けられている。最初のカテゴリは、線維トラクトの伝播2,8,9の各ステップのローカルテンソル情報を用いて、線伝搬アルゴリズムに基づいている:現在、二種類に分けることができたWMトラクトを再構成するには、いくつかの異なるアプローチが存在する。第二のカテゴリーは、管ベースの空間統計学の手法では得られた2 WM領域間の精力的に最も有利なパスを見つけることが世界のエネルギー最小化に基づいている(TBSS)などtractwise異方性比率の統計(TFASとして他のアルゴリズムで使用されてきた10 – プロトコルテキスト、セクション2.4を参照)。
定位スタンドに変身ARDスペース
その他の高度なMRIの方法と同様に、臨床的な文脈でDTIとFTベースの研究では11メートル、一部差別に基づく診断プロセスを容易にするために、個々の患者の脳の形態を分類するために究極の目標を追求しています。共通の臨床表現型は、1つ以上の特定の脳領域または特定の神経解剖学的ネットワークへの損傷に起因することになっている場合、グループレベルの研究では、最も関連する。ここでは、別の科目の結果を平均すると、微細構造変化の共通パターンを評価するために有用です。個々の脳定位固定空間に移送しなければならないように、第二工程において、ボクセル毎ボクセルレベルでの結果の平均化演算が可能である。空間的な正規化は、信号対雑音比(SNR)を改善し、患者のサンプルと続きの比較を行うために、異なる被験者から得られた結果の算術平均に許容されるROLSは、特定の疾患の病理解剖学計算を分析するために、特定の脳システムのふりをすることに関連付けられている神経変性疾患、例えば 。
12で標準化された定位空間に正規化の早期のアプローチは、様々な脳のランドマークと脳象限の断片的なスケーリングの識別を含む標準的なアトラスに変換アルゴリズムを提案した。今日では、高度なMRIデータ解析パッケージのほとんどはモントリオール神経学研究所(MNI)定位空間13への正規化を使用しています。この変換では、研究の特定のテンプレートを使って半自動と自動脳登録アルゴリズムは14,15を開発しました。 DTIにおいて、特別な注意は正規化プロセス16,17の間に方向情報を保存するために描かれなければならない。空間的な正規化のために必要とされるDT-MR画像に空間的な変換の応用データセットのコレクションのDTSは再び変換によって影響される配向情報が含まれているという事実によって複雑に反りスカラー画像とは対照的である。この効果は、変換画像の解剖学的な正確さを保証するために考慮する必要があります。ここで、DTIデータセットにアフィン変換を適用するための技術が示されている。
脳疾患への応用DTI
縦DTIデータの比較は、お互いの間で一つの主題のデータの配置/登録が必要です。その意味で、方向情報の保存は(アフィン変換中に拡散テンソルすなわち回転)が必要です。神経変性疾患の可能な用途( 例えば 、18,19)は、以前に報告されている。
DTIは、in vivo neuropathol に調査する堅牢な非侵襲的な技術的なツールとして確立されているWM神経管のOGY( 例えば 11,20,21,22)。拡散プロセスのDTIベースの定量的な測定基準は、FA、例えば 、すでにそのようなストローク20、多発性硬化症23、筋萎縮性側索硬化症24、25、アルツハイマー病26とWM病変の広い範囲を研究するための敏感なマーカーであることが示されている、および他のいくつかのWM障害27,28。
また、FTとDTIは、WMの管23を識別するために使用することができる。まだしない日常的な臨床使用中にこの技術は、神経疾患における経路特異的な異常を評価するための強力な手段として浮上している。識別路内では、DTIデータに解剖学的にcoregisteredあるDTI由来の様々な定量的MRI指標と追加取得( 例えば T2強調画像及び/又は磁化移動(MT)イメージング)を測定することができます。これにより、各インデックスはcalculかもしれません管プロファイルとしての空間的な変動を示すプロットを参照して、管内での位置の関数としてated。
1.5で行った次の、人間のDTIのスキャンでテスラMRI-スキャナは(シーメンスメディカル、エアランゲン、ドイツ)患者群だけでなく、個人での白質の異常を検出するための様々な解析手法の可能性を調査するために使用された。アーティファクトの他の種類のモーション破損ボリュームとボリュームの除去のための自動化された品質チェックの後、標準化された後処理手順は、連続した分析用のDTIのデータを準備する。異なる分析アプローチは、以下に示すように、 すなわち空間統計基づいて、最初の、全脳(WBSS)、第二、FT、および第三、Tractwise異方性比率の統計(TFAS)。されますWBSSは通常DTIデータ(VBM / DTI)上のボクセルベースの形態計測/統計として知られているボクセルベースの形態計測(VBM)と同様に動作します方法です<emは>。VBMは、もともと別のスキャンのコントラスト差がWBSSが物理パラメータのvoxelwise比較を用いる方法である間に解決されなければならないコントラスト画像上で実行されるメソッドです。アルゴリズム的に類似しているにも関わらず、そのWBSSとVBMの差別化されている用語は、以下で使用されます。
Protocol
Representative Results
Discussion
DTIデータの被験者間の平均は、それぞれ、拡散振幅(FA情報を用いて)と拡散方向(FTに基づく)に対して実現することができる。 FAマップの平均化はWBSSとTFASによって対象グループの統計を比較することができます。この方法論のフレームワークは、被験者間の平均とグループの比較でDTIのテクニックに紹介します。定位正規化およびグループレベルのFAマップの比較は、対象群間の差?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究の一部は、QCや多動障害の患者のデータに適用して破損した勾配方向の補正に関する研究、すなわち欧州のHDネットワーク(EHDNプロジェクト070)によってサポートされていました。この特定の研究ではMRIスキャンは、ロンドンのサイトTRACK-HDコホートの一環として取得した。
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
Riferimenti
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

