Swimmeret Система Раки: Практическое руководство для рассечения нервной цепочки и внеклеточной регистрацию структуры Motor
Summary
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Abstract
Здесь мы демонстрируем рассечение раков брюшной нервной цепочки. Препарат содержит две последние грудных ганглиев (T4, T5) и цепь брюшной ганглиях (А1-А6). Эта цепочка ганглиев включает в себя часть центральной нервной системы (ЦНС), что приводит скоординированной локомоции плеоподов (swimmerets): системы swimmeret. Он известен более пяти десятилетий, что в раков друг swimmeret управляется своим собственным независимым картины генерации ядра, который генерирует ритмичные переменного Задание 1-3. Моторные нейроны, иннервирующие мускулатуру каждого swimmeret состоять из двух анатомически и функционально различных групп населения 4. Один отвечает за отвода мощности (инсульт, PS) в swimmeret. Другие диски затяжного (обратный ход, RS) в swimmeret. Моторные нейроны swimmeret системы способны производить спонтанно фиктивный двигателя узор, который идентичен образцу, записанной в естественных условиях </EM> 1.
Целью данного отчета является ознакомление интересный и удобный модельную систему для изучения ритма генерирующих сетей и координации независимых микросхем для практических лабораторных курсов студентов. Протокол условии включает в себя шаг за шагом инструкции для вскрытия брюшной нервной цепочки раков, в пиннинга изолированной цепи ганглиев, desheathing ганглиев и записи swimmerets фиктивный шаблон двигателя внеклеточно от изолированных нервной системы.
Кроме того, мы можем контролировать деятельность swimmeret нейронов, записанных внутриклеточно из дендритов. Здесь мы также кратко описать эти методы и приведем несколько примеров. Кроме того, морфология swimmeret нейронов может быть оценена с помощью различных методов окрашивания. Здесь мы приводим примеры внутриклеточных (ионтофорезом) красителя заполнено нейронов и backfills бассейнов в swimmeret двигательных нейронов. В нашей лабораториимы используем этот препарат для изучения основных функций фиктивного передвижения, эффект сенсорной обратной связи о деятельности ЦНС и координации между микросхемами на клеточном уровне.
Introduction
В swimmerets раков выполнять функцию в контроле позы и бить ритмично, когда животные плавать вперед, проветрите их норы или женщины проветрить свои яйца 5, 6. The swimmerets сигнала раков, Pacifastacus leniusculus, встречаются парами из второго по пятое брюшной сегмент, с одной конечности на каждой стороне брюшной полости 7. Центральной нервной системы производит на собственной ритмической двигателя стук, который приводит в движение swimmeret в интактных животных, а также в изолированном препарате нервной цепочки. Когда нет сенсорная обратная связь или убывания вход настоящее ритмичный двигатель модели производятся называется фиктивным передвижение 1, 2. В системе swimmeret этот двигатель модели не отличается какого-либо параметра от деятельности swimmerets, измеренных в интактных животных.
Движение каждого swimmeret управляется микросхемой, который находится в и ограничивается одной сorresponding hemiganglion 1 -. 3 В каждой микросхемы есть шаблон генерации ядра, включает в себя пять выявленных удобства всплески интернейронов. Они могут быть функционально характеризуется либо как ингибитор хода силы (IPS) или ингибитор обратного хода (IRS) 8. Эти IPS и IRS интернейронов не являются эндогенными генераторы, а их переменный деятельность обусловлена взаимного ингибирования 9. Потому что эти интернейронов ингибировать swimmeret моторные нейроны напрямую, переменное движение PS-RS генерируется 10. Передвижение однако, не только требуют создания деятельности, но и координации различных независимых микросхем. В системе swimmeret такая координация устанавливается координационного микросхемы, которая гарантирует, что конечности являются активными в правильное время. Эта микросхема построена на трех определенных нейронов в каждом сегменте 11-15.
Этот протокол предусматривает гое первый раз шаг за шагом рассечение руководство, чтобы изолировать цепь ганглиев (T4 до A6, рис 1). Мы покажем, как прикрепить Изолированная абдоминальная нервный тяж и desheathe каждый ганглий. В этом изолированном препарате нервной системы, нейроны, отвечающие за движения swimmeret готовы для использования в электрофизиологических и морфологических экспериментов. Вторая часть этого протокола демонстрирует основные особенности swimmeret узором двигателя. Это включает в себя шаг за шагом руководство для внеклеточно записи активности swimmeret двигательных нейронов. Аксоны двигательных RS нейроны проецируются через передней ветви нерва N1, в то время как аксоны PS двигательных нейронов проекта через заднюю ветви одного и того же нерва (рис 1) 4. Поэтому их деятельность может быть записано от этих отраслей с помощью дифференциальных контактных электродов.
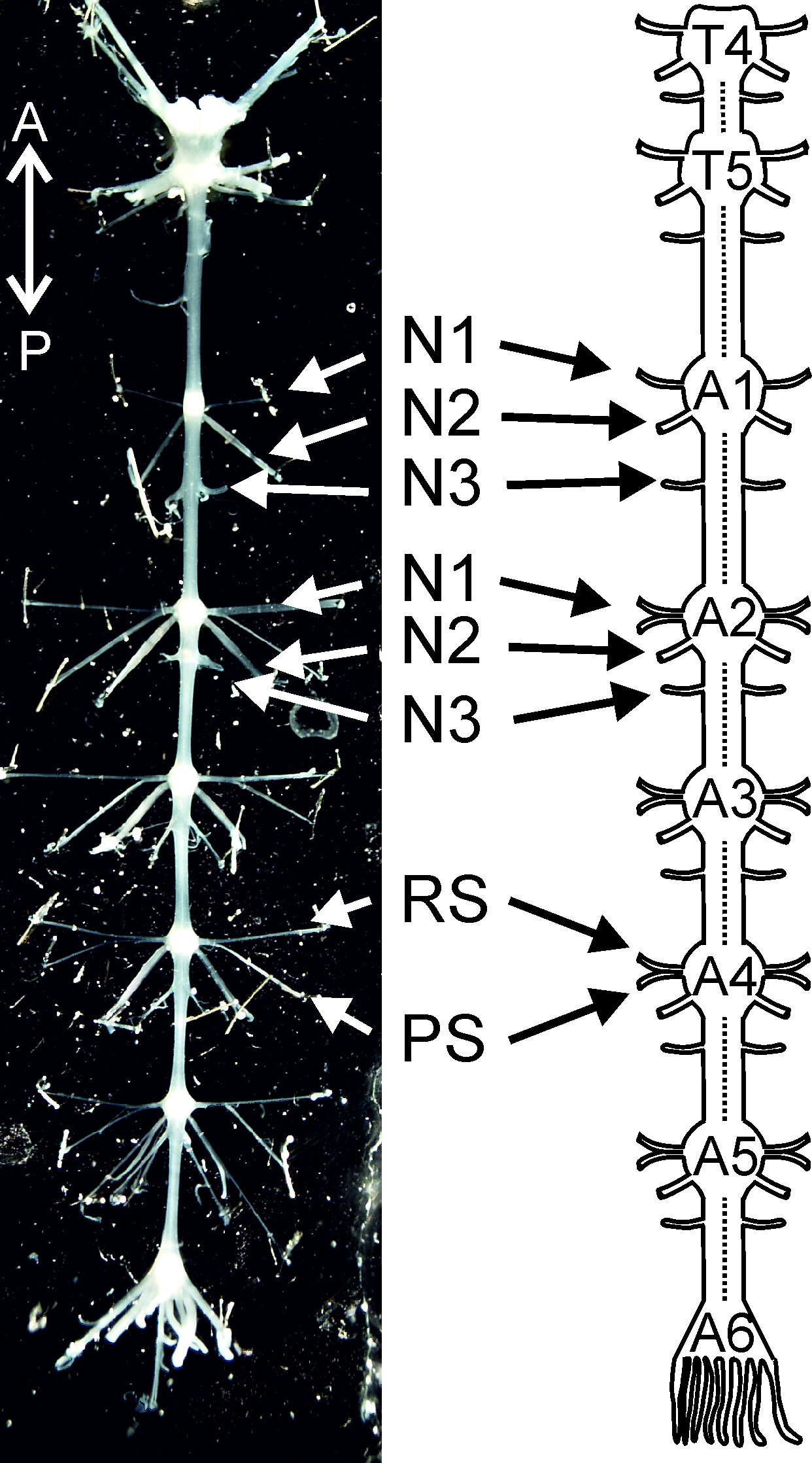 <br/> Рисунок 1: Изолированные нервной системы от грудного ганглия 4 (Т4) в брюшной ганглий 6 (A6) и принципиальная схема, что Т4.: Грудной ганглий 4; T5: грудной ганглий 5; A1, A2 … A6 брюшной ганглий 1, брюшной ганглий 2 … брюшной ганглий 6; N1: нерв N1; N2: нерв N2; N3: нерв N3; PS: рабочий ход; RS: возвращение-тактный. Направленные сокращения: = Передняя; P = задний.
<br/> Рисунок 1: Изолированные нервной системы от грудного ганглия 4 (Т4) в брюшной ганглий 6 (A6) и принципиальная схема, что Т4.: Грудной ганглий 4; T5: грудной ганглий 5; A1, A2 … A6 брюшной ганглий 1, брюшной ганглий 2 … брюшной ганглий 6; N1: нерв N1; N2: нерв N2; N3: нерв N3; PS: рабочий ход; RS: возвращение-тактный. Направленные сокращения: = Передняя; P = задний.
Эта процедура рассечение и электрофизиологические техника продемонстрировала удобны для студентов и могут дополнять студентов практические занятия по физиологии. Изолированные цепи ганглиев был использован в ряде экспериментов по изучению функции нервной системы, координацию, или модуляцию swimmeret микросхем 6, а также нейронную контроль адаптивного поведения в локомоции 16, 17. Таким образом, система раков swimmeret обеспечивает огромное количество интересной преподавательской или тдождь возможности, которые все начинаются с рассечением брюшной нервной раков и внеклеточной записи фиктивного узором двигателя.
Protocol
Representative Results
Discussion
Анатомия рака и их животе ганглии было описано ранее 5, 18, 19, 20, и рекомендуется, чтобы ознакомиться с ними до вскрытия для того, чтобы избежать сокращения важных нервов.
Очень важно, чтобы препарат при температуре ниже 23 ° C для предотвращения деградации изолир…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Jos Бургерт за помощь некоторые цифры. Мы благодарны Инго Selbach (и группы "Edelkrebsprojekt NRW") за его усилия на поставку в лабораторию с экспериментальными животными. Мы благодарим Анну К. Шнайдер за вычитку первые версии рукописи. Это исследование было поддержано грант Эмми Нётер DFG SM 206 / 3-1 и запуска гранта университета Кельна для женской факультета.
Materials
| Name of Material/ Equipment | Tipo | Company | Catalog Number | Comments/ Description |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | for extracellular recording | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA |
63-534 | for intracellular recording | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A | digitizes recorded signals |
| big bucket | filled with ice | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard | for extracellular recording |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 | |
| computer and monitor | equipped with recording software | for extracellular recording | ||
| container and pipette for liquid waste | ||||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | always keep at temperatures ~ 4° C | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 | for intracellular dyefill of neurons |
| differential pin electrodes | made from stainless steel ɸ 0.2 mm | for extracellular recording | ||
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | used in the gross disection | ||
| faraday cage | for extracellular recording | |||
| fixing pins | for pinning the specimen | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 | fine forceps: used to pick nerves |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 | extra fine forceps: used for desheathing |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 | coarse forceps: used to grab specimen and pins |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 | for intracellular recording and dyefill of neurons |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x – 8x | Leica, Germany | 10446298 | for extracellular recording |
| microscope table | for extracellular recording | |||
| mirror | to illuminate preparation from below | for extracellular recording | ||
| modeling clay | for extracellular recording | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x – 4.5x | Olympus, Germany | for the dissection | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 | used to pin the isolated chain of ganglia |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 | for gross dissection (steps 2.1 – 2.11) |
| saline dispenser with a 16 gauge needle (outer ɸ 1.6mm) attached via a flexible tube. | Volume ~ 60ml, | used for exsanguination | ||
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 | for desheathing |
| stainless steel wire ɸ 0.125 mm | to cut pins of 4-7 mm length | Goodfellow GmbH, Bad Nauheim, Germany | for pinning of the nerve cord | |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 | for gross and fine disection (steps 2.11 – 3.14) |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | ||
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip | for extracellular recording |
Riferimenti
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45 (2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. . The crayfish: An introduction to the study of zoology. , (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts – Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M., Strausfeld, N. J., Miller, T. A. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. , 373-402 (1980).

