Выделение проксимальных жидкостей для исследования микроокружения опухоли аденокарциномы поджелудочной железы
Summary
Панкреатический сок является ценным источником биомаркеров рака поджелудочной железы человека. Здесь описан метод интраоперационной процедуры сбора. Чтобы преодолеть проблему принятия этой процедуры в мышиных моделях, мы предлагаем альтернативный образец, опухолевую интерстициальную жидкость, и описываем здесь два протокола для ее выделения.
Abstract
Аденокарцинома поджелудочной железы (PDAC) является четвертой по значимости причиной смерти, связанной с раком, и вскоре станет второй. Существует острая потребность в переменных, связанных со специфическими патологиями поджелудочной железы, чтобы помочь предоперационной дифференциальной диагностике и профилированию пациентов. Панкреатический сок представляет собой относительно неисследованную жидкость организма, которая благодаря своей непосредственной близости к месту опухоли отражает изменения в окружающих тканях. Здесь мы подробно опишем процедуру интраоперационного сбора. К сожалению, перевод сбора панкреатического сока на мышиные модели PDAC для выполнения механистических исследований технически очень сложен. Опухолевая интерстициальная жидкость (TIF) представляет собой внеклеточную жидкость, находящуюся вне крови и плазмы, которая омывает опухолевые и стромальные клетки. Подобно соку поджелудочной железы, из-за его свойства собирать и концентрировать молекулы, которые находятся разбавленными в плазме, TIF может использоваться в качестве индикатора микроокружающих изменений и в качестве ценного источника биомаркеров, связанных с заболеванием. Поскольку TIF не является легкодоступным, были предложены различные методы его изоляции. Здесь мы опишем два простых и технически нетребовательных метода его выделения: тканевое центрифугирование и тканевое элюирование.
Introduction
Аденокарцинома протоков поджелудочной железы (PDAC) является одной из самых агрессивных опухолей, и вскоре станет второй по значимости причиной смерти 1,2,3. Он хорошо известен своей иммуносупрессивной микросредой и своей неспособностью реагировать на протоколы иммунотерапии4. В настоящее время хирургическая резекция по-прежнему является единственным лечебным вариантом для PDAC, но существует высокая частота ранних рецидивов и послеоперационных осложнений. Отсутствие специфических симптомов до запущенной стадии не позволяет провести раннюю диагностику, способствуя срокам заболевания. Кроме того, перекрытие симптомов между PDAC и другими доброкачественными патологиями поджелудочной железы может препятствовать достижению быстрой и надежной диагностики с текущими диагностическими стратегиями. Идентификация переменных, связанных с конкретными патологиями поджелудочной железы, может облегчить процесс принятия хирургических решений и улучшить профилирование пациентов.
Многообещающие результаты в открытии биомаркеров были достигнуты с использованием легкодоступных жидкостей организма, таких как кровь 5,6,7, моча8, слюна9 и панкреатический сок 10,11,12. Во многих исследованиях использовались комплексные «омические» подходы, такие как геномные, протеомные и метаболомные методы, для идентификации молекул-кандидатов или сигнатур, которые могут различать PDAC и другие доброкачественные заболевания поджелудочной железы. Недавно мы продемонстрировали, что панкреатический сок, относительно неисследованная жидкость организма, может быть использован для идентификации метаболических сигнатур пациентов с различными клиническими профилями12. Панкреатический сок представляет собой богатую белком жидкость, которая накапливает секретом клеток протоков поджелудочной железы и поступает в главный проток поджелудочной железы, а затем в основной общий желчный проток. Из-за своей близости к поджелудочной железе на него могут сильно влиять микроокружательные возмущения, индуцированные опухолевой массой (рисунок 1), и, следовательно, более информативные, чем кровь или моча, или профилирование на основе тканей. В нескольких исследованиях изучался потенциал панкреатического сока для выявления новых биомаркеров заболевания с использованием различных подходов, включая цитологический анализ13, протеомный анализ, выполненный масс-спектрометрией 14,15, оценку генетических и эпигенетических маркеров, таких как мутации K-ras и p53 16,17, изменения в метилировании ДНК18 и миРНК 19 . Технически панкреатический сок может быть собран интраоперационно или с помощью минимально инвазивных процедур, таких как эндоскопическое ультразвуковое исследование, ретроградная холангио-панкреатография или эндоскопический сбор секреции дуоденального сока20. Пока не ясно, в какой степени на состав панкреатического сока влияет используемая методика сбора. Мы описываем здесь процедуру интраоперационного сбора и показываем, что панкреатический сок может представлять собой ценный источник биомаркеров PDAC.
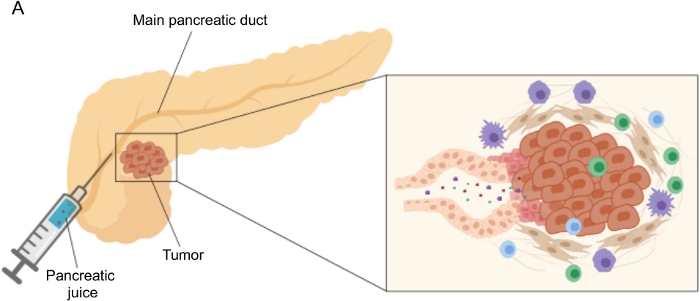
Рисунок 1: Схематическое изображение сбора сока поджелудочной железы. (А) Схематическое изображение, изображающее секрецию панкреатического сока в проток поджелудочной железы и его сбор во время операции. Вставка показывает крупный план микроокружения опухоли: панкреатический сок собирает молекулы, высвобождаемые опухолевыми и стромальными клетками в протоках поджелудочной железы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Коллекция панкреатического сока в генетических и ортотопических мышиных моделях PDAC была бы оценена в перспективе использования этой биожидкости в доклинических механистических исследованиях; однако эта процедура может быть технически очень сложной и неосуществимой для более простых моделей, таких как подкожные опухоли. По этой причине мы идентифицировали опухолевую интерстициальную жидкость (TIF) в качестве альтернативного источника панкреатического сока, поскольку она сходная характеристика действует как индикатор окружающих возмущений. Интерстициальная жидкость (ИФ) представляет собой внеклеточную жидкость, обнаруженную вне кровеносных и лимфатических сосудов, которая омывает клеткиткани 21. На состав ПЧ влияет как кровообращение в органе, так и местная секреция; фактически, окружающие клетки активно продуцируют и секретируют белки в IF21. Интерстиций отражает микроокружательные изменения окружающих тканей и, следовательно, может представлять собой ценный источник для обнаружения биомаркеров в нескольких патологических контекстах, таких как опухоли. Высокая концентрация локально секретируемых белков в TIF может быть использована для идентификации молекул-кандидатов для тестирования в качестве прогностических или диагностических биомаркеров в плазме 22,23,24. Несколько исследований доказали, что TIF является подходящим образцом для высокопроизводительных протеомных подходов, таких как методы масс-спектрометрии23,24,25, а также мультиплексные подходы ИФА26 и профилирование микроРНК27.
Было предложено несколько подходов к выделению МФ в опухолях, которые можно в широком смысле классифицировать как in vivo (капиллярная ультрафильтрация 28,29,30,31 и микродиализ 32,33,34,35) и методы ex vivo (тканевая центрифугирование 22,36,37,38 и тканевое элюирование 39,40,41,42). Эти методы были подробно рассмотрены43,44. При выборе соответствующего метода следует учитывать такие вопросы, как последующий анализ и применение, а также восстановленный объем. Недавно мы использовали этот подход в качестве доказательства принципа для демонстрации различной метаболической активности опухолей из двух клеточных линий аденокарциномы мышей поджелудочной железы12. Основываясь на литературе24,38, мы решили использовать метод центрифугирования с низкой скоростью, чтобы избежать разрушения и разбавления клеток от внутриклеточного содержимого. Как количество глюкозы, так и лактата в TIF отражало различные гликолитические характеристики двух разных клеточных линий. Здесь мы подробно опишем протокол для двух наиболее часто используемых методов выделения TIF: тканевого центрифугирования и тканевого элюирования (рисунок 2).
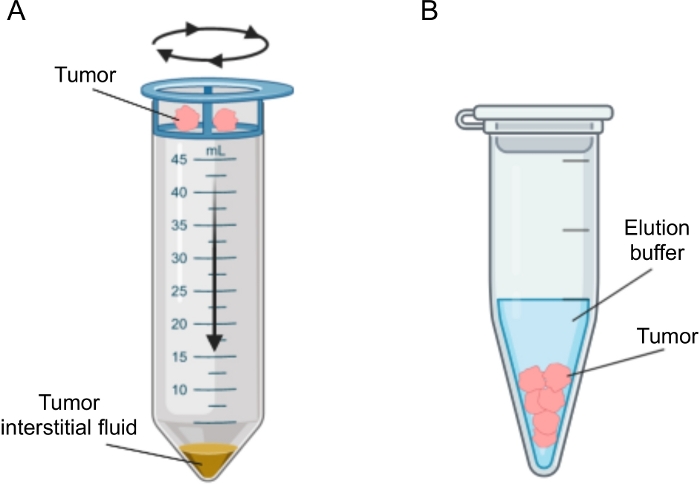
Рисунок 2: Схематическое изображение методов выделения опухолевой интерстициальной жидкости. Схематическая иллюстрация методов, подробно описанных в протоколе, а именно центрифугирования тканей (А) и тканевого элюирования (В). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
В этом исследовании мы описали технику интраоперационного сбора сока поджелудочной железы, в значительной степени неисследованную жидкую биопсию. Недавно мы показали, что панкреатический сок может быть использован в качестве источника метаболических маркеров заболевания12…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Роберту Мильоре за техническую помощь. Исследование, приведшее к этим результатам, получило финансирование от Associazione Italiana per la ricerca sul cancro (AIRC) в рамках проекта IG2016-ID.18443 – P.I. Marchesi Federica. Спонсоры не играли никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Riferimenti
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Ricerca sul cancro. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

