Aislamiento de líquidos proximales para investigar el microambiente tumoral del adenocarcinoma pancreático
Summary
El jugo pancreático es una fuente preciosa de biomarcadores para el cáncer de páncreas humano. Describimos aquí un método para el procedimiento de recolección intraoperatoria. Para superar el desafío de adoptar este procedimiento en modelos murinos, sugerimos una muestra alternativa, el líquido intersticial tumoral, y describimos aquí dos protocolos para su aislamiento.
Abstract
El adenocarcinoma pancreático (PDAC) es la cuarta causa principal de muerte relacionada con el cáncer, y pronto se convertirá en la segunda. Existe una necesidad urgente de variables asociadas a patologías pancreáticas específicas para ayudar al diagnóstico diferencial preoperatorio y al perfil del paciente. El jugo pancreático es un fluido corporal relativamente inexplorado que, debido a su proximidad al sitio del tumor, refleja cambios en el tejido circundante. Aquí describimos en detalle el procedimiento de recolección intraoperatoria. Desafortunadamente, traducir la recolección de jugo pancreático a modelos murinos de PDAC, para realizar estudios mecanicistas, es técnicamente muy desafiante. El líquido intersticial tumoral (TIF) es el líquido extracelular, fuera de la sangre y el plasma, que baña las células tumorales y del estroma. Al igual que el jugo pancreático, por su propiedad de recolectar y concentrar moléculas que se encuentran diluidas en plasma, TIF puede ser explotado como un indicador de alteraciones microambientales y como una valiosa fuente de biomarcadores asociados a enfermedades. Dado que TIF no es fácilmente accesible, se han propuesto varias técnicas para su aislamiento. Describimos aquí dos métodos simples y técnicamente poco exigentes para su aislamiento: centrifugación tisular y elución tisular.
Introduction
El adenocarcinoma ductal pancreático (PDAC) es uno de los tumores más agresivos y pronto se convertirá en la segunda causa de muerte 1,2,3. Es bien conocido por su microambiente inmunosupresor y por su falta de respuesta a los protocolos de inmunoterapia4. Actualmente, la resección quirúrgica sigue siendo la única opción curativa para el PDAC, sin embargo, hay una alta frecuencia de recaídas tempranas y complicaciones posquirúrgicas. La falta de síntomas específicos hasta una etapa avanzada no permite un diagnóstico precoz, contribuyendo a la caducidad de la enfermedad. Además, la superposición de síntomas entre PDAC y otras patologías pancreáticas benignas puede dificultar el logro de un diagnóstico rápido y confiable con las estrategias diagnósticas actuales. La identificación de variables asociadas a patologías pancreáticas específicas podría facilitar la toma de decisiones quirúrgicas y mejorar el perfil del paciente.
Se han logrado resultados prometedores en el descubrimiento de biomarcadores utilizando fluidos corporales de fácil acceso, como sangre 5,6,7, orina8, saliva 9 y jugo pancreático10,11,12. Muchos estudios han explotado enfoques integrales de “ómicas”, como técnicas genómicas, proteómicas y metabolómicas, para identificar moléculas candidatas o firmas que podrían discriminar entre PDAC y otras afecciones pancreáticas benignas. Recientemente demostramos que el jugo pancreático, un fluido corporal relativamente inexplorado, puede ser utilizado para identificar firmas metabólicas de pacientes con perfiles clínicos distintos12. El jugo pancreático es un líquido rico en proteínas, que acumula el secretoma de las células ductales pancreáticas y fluye hacia el conducto pancreático principal, y luego hacia el conducto biliar común principal. Debido a su proximidad al páncreas, podría verse fuertemente afectado por perturbaciones microambientales inducidas por la masa tumoral (Figura 1) y, por lo tanto, más informativo que la sangre o la orina, o el perfil basado en tejidos. Varios estudios han explorado el potencial del jugo pancreático para identificar nuevos biomarcadores de enfermedad utilizando diversos enfoques, incluyendo el análisis citológico 13, el análisis proteómico realizado por espectrometría de masas 14,15, la evaluación de marcadores genéticos y epigenéticos como las mutaciones K-ras y p53 16,17, alteraciones en la metilación del ADN 18 y miRNAs 19 . Técnicamente, el jugo pancreático puede ser recolectado intraoperatoriamente o con procedimientos mínimamente invasivos, como ultrasonido endoscópico, colangiopancreatografía retrógrada o por recolección endoscópica de secreción de jugo duodenal20. Todavía no está claro en qué medida la composición del jugo pancreático se ve afectada por la técnica de recolección utilizada. Describimos aquí el procedimiento de recolección intraoperatoria y mostramos que el jugo pancreático puede representar una fuente valiosa de biomarcadores PDAC.
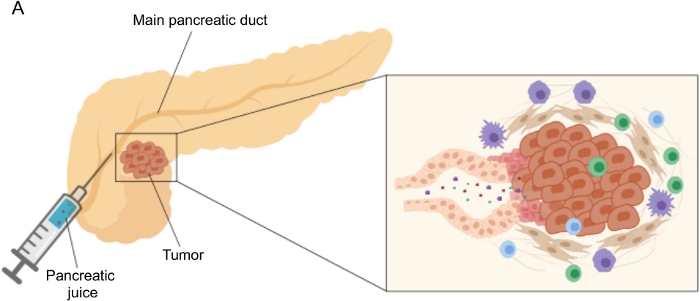
Figura 1: Representación esquemática de la recolección de jugo pancreático. (A) Representación esquemática que representa la secreción de jugo pancreático en el conducto pancreático y su recolección durante la cirugía. El recuadro muestra un primer plano del microambiente tumoral: el jugo pancreático recoge moléculas liberadas por las células tumorales y estromales en los conductos pancreáticos. Haga clic aquí para ver una versión más grande de esta figura.
La recolección de jugo pancreático en modelos genéticos y ortotópicos de ratón de PDAC sería apreciada en la perspectiva de explotar este biofluido en estudios mecanicistas preclínicos; Sin embargo, este procedimiento puede ser técnicamente muy desafiante y no es factible para modelos más simples, como los tumores subcutáneos. Por esta razón, identificamos el líquido intersticial tumoral (TIF) como una fuente alternativa al jugo pancreático, por su característica similar de actuar como un indicador de perturbaciones circundantes. El líquido intersticial (IF) es el líquido extracelular, que se encuentra fuera de los vasos sanguíneos y linfáticos, que baña las células tisulares21. La composición del FI se ve afectada tanto por la circulación sanguínea al órgano como por la secreción local; de hecho, las células circundantes producen y secretan activamente proteínas en el IF21. El intersticio refleja los cambios microambientales de los tejidos circundantes y, por lo tanto, podría representar una fuente valiosa para el descubrimiento de biomarcadores en varios contextos patológicos, como los tumores. La alta concentración de proteínas secretadas localmente en TIF puede ser utilizada para identificar moléculas candidatas para ser probadas como biomarcadores pronósticos o diagnósticos en plasma22,23,24. Varios estudios han demostrado que TIF es una muestra adecuada para enfoques proteómicos de alto rendimiento, como las técnicas de espectrometría de masas 23,24,25, así como los enfoques ELISA multiplex 26 y el perfil de microARN 27.
Se han propuesto varios enfoques para el aislamiento del AI en tumores, que pueden clasificarse ampliamente como di vivo (ultrafiltración capilar 28,29,30,31 y microdiálisis 32,33,34,35) y métodos ex vivo (centrifugación tisular 22,36,37,38 y elución tisular 39,40,41,42). Estas técnicas han sido revisadas con gran detalle43,44. La elección del método adecuado debe tener en cuenta cuestiones como los análisis y aplicaciones posteriores y el volumen recuperado. Recientemente utilizamos este enfoque como prueba de principio para demostrar la diferente actividad metabólica de los tumores de dos líneas celulares murinas de adenocarcinoma pancreático12. Con base en la literatura24,38, optamos por utilizar el método de centrifugación de baja velocidad para evitar la rotura celular y la dilución del contenido intracelular. Tanto la cantidad de glucosa como de lactato en TIF reflejaban las diferentes características glucolíticas de las dos líneas celulares diferentes. Aquí describimos en detalle el protocolo para los dos métodos más utilizados para el aislamiento de TIF: centrifugación tisular y elución tisular (Figura 2).
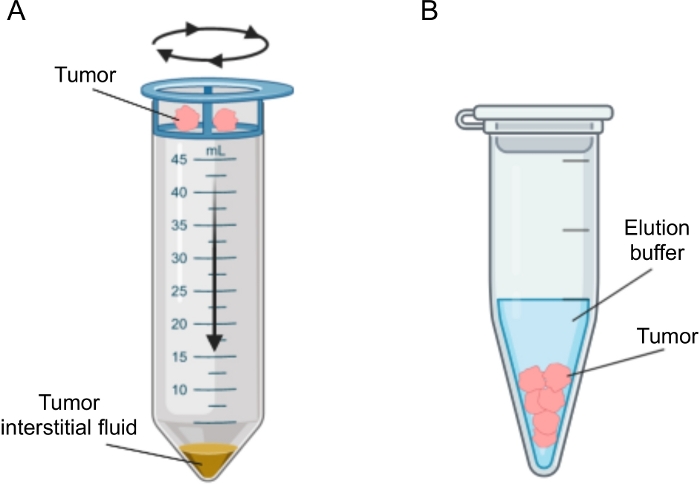
Figura 2: Representación esquemática de los métodos de aislamiento del líquido intersticial tumoral. Ilustración esquemática de las técnicas descritas en detalle en el protocolo, a saber, centrifugación tisular (A) y elución tisular (B). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
En este estudio hemos descrito la técnica para recolectar intraoperatoriamente jugo pancreático, una biopsia de líquido en gran parte inexplorada. Recientemente hemos demostrado que el jugo pancreático puede ser explotado como fuente de marcadores metabólicos de la enfermedad12. El análisis metabolómico en otras biopsias líquidas, como sangre 5,6,7, orina8 y saliva9,<sup cl…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Roberta Migliore por su asistencia técnica. La investigación que condujo a estos resultados ha recibido financiación de la Associazione Italiana per la ricerca sul cancro (AIRC) bajo el proyecto IG2016-ID.18443 – P.I. Marchesi Federica. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Riferimenti
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Ricerca sul cancro. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

