Isolierung proximaler Flüssigkeiten zur Untersuchung der Tumormikroumgebung des Pankreas-Adenokarzinoms
Summary
Pankreassaft ist eine wertvolle Quelle von Biomarkern für menschlichen Bauchspeicheldrüsenkrebs. Wir beschreiben hier eine Methode für das intraoperative Sammelverfahren. Um die Herausforderung zu meistern, dieses Verfahren in Mausmodellen anzuwenden, schlagen wir eine alternative Probe, die interstitielle Tumorflüssigkeit, vor und beschreiben hier zwei Protokolle für ihre Isolierung.
Abstract
Das Adenokarzinom der Bauchspeicheldrüse (PDAC) ist die vierthäufigste krebsbedingte Todesursache und wird bald die zweithäufigste werden. Es besteht ein dringender Bedarf an Variablen, die mit spezifischen Pankreaspathologien verbunden sind, um die präoperative Differentialdiagnose und die Patientenprofilierung zu unterstützen. Pankreassaft ist eine relativ unerforschte Körperflüssigkeit, die aufgrund ihrer Nähe zur Tumorstelle Veränderungen im umgebenden Gewebe widerspiegelt. Hier beschreiben wir ausführlich das intraoperative Sammelverfahren. Leider ist die Übersetzung der Pankreassaftsammlung in murine PDAC-Modelle, um mechanistische Studien durchzuführen, technisch sehr anspruchsvoll. Tumorinterstitielle Flüssigkeit (TIF) ist die extrazelluläre Flüssigkeit außerhalb von Blut und Plasma, die Tumor- und Stromazellen badet. Ähnlich wie Pankreassaft kann TIF aufgrund seiner Eigenschaft, Moleküle, die im Plasma verdünnt gefunden werden, zu sammeln und zu konzentrieren, als Indikator für mikroökologische Veränderungen und als wertvolle Quelle für krankheitsassoziierte Biomarker genutzt werden. Da TIF nicht leicht zugänglich ist, wurden verschiedene Techniken für seine Isolierung vorgeschlagen. Wir beschreiben hier zwei einfache und technisch anspruchslose Methoden zur Isolierung: Gewebezentrifugation und Gewebeelution.
Introduction
Das duktale Adenokarzinom der Bauchspeicheldrüse (PDAC) ist einer der aggressivsten Tumoren und wird bald die zweithäufigste Todesursachesein 1,2,3. Es ist bekannt für seine immunsuppressive Mikroumgebung und für seine Nichtreaktion auf Immuntherapieprotokolle4. Derzeit ist die chirurgische Resektion immer noch die einzige kurative Option für PDAC, aber es gibt eine hohe Häufigkeit von frühen Rückfällen und postoperativen Komplikationen. Das Fehlen spezifischer Symptome bis zu einem fortgeschrittenen Stadium ermöglicht keine frühzeitige Diagnose, was zur Pünktlichkeit der Krankheit beiträgt. Darüber hinaus kann die Überlappung der Symptome zwischen PDAC und anderen gutartigen Pankreaspathologien das Erreichen einer schnellen und zuverlässigen Diagnose mit den aktuellen Diagnosestrategien behindern. Die Identifizierung von Variablen, die mit spezifischen Pankreaspathologien assoziiert sind, könnte den chirurgischen Entscheidungsprozess erleichtern und die Erstellung von Patientenprofilen verbessern.
Vielversprechende Ergebnisse bei der Entdeckung von Biomarkern wurden mit leicht zugänglichen Körperflüssigkeiten wie Blut 5,6,7, Urin8, Speichel 9 und Pankreassaft10,11,12 erzielt. Viele Studien haben umfassende “Omics”-Ansätze wie genomische, proteomische und metabolomische Techniken genutzt, um Kandidatenmoleküle oder Signaturen zu identifizieren, die zwischen PDAC und anderen gutartigen Pankreaserkrankungen unterscheiden könnten. Wir haben kürzlich gezeigt, dass Pankreassaft, eine relativ unerforschte Körperflüssigkeit, verwendet werden kann, um metabolische Signaturen von Patienten mit unterschiedlichen klinischen Profilen zu identifizieren12. Pankreassaft ist eine proteinreiche Flüssigkeit, die das Sekretom der Pankreasduktalzellen ansammelt und zum Hauptgang der Bauchspeicheldrüse und dann zum Hauptgallengang fließt. Aufgrund seiner Nähe zur Bauchspeicheldrüse könnte es stark von mikroumweltbedingten Störungen beeinflusst werden, die durch die Tumormasse induziert werden (Abbildung 1) und daher aussagekräftiger sind als Blut oder Urin oder gewebebasiertes Profiling. Mehrere Studien haben das Potenzial von Pankreassaft zur Identifizierung neuer Biomarker von Krankheiten mit verschiedenen Ansätzen untersucht, einschließlich zytologischer Analyse 13, proteomischer Analyse durch Massenspektrometrie 14,15, Bewertung genetischer und epigenetischer Marker wie K-ras- und p53-Mutationen 16,17, Veränderungen der DNA-Methylierung 18 und miRNAs 19 . Technisch gesehen kann Pankreassaft intraoperativ oder mit minimalinvasiven Verfahren wie endoskopischem Ultraschall, retrograder Cholangio-Pankreatographie oder durch endoskopische Entnahme von Zwölffingerdarmsaftsekretion20 gewonnen werden. Es ist noch nicht klar, inwieweit die Pankreassaftzusammensetzung durch die verwendete Sammeltechnik beeinflusst wird. Wir beschreiben hier das intraoperative Sammelverfahren und zeigen, dass Pankreassaft eine wertvolle Quelle für PDAC-Biomarker darstellen kann.
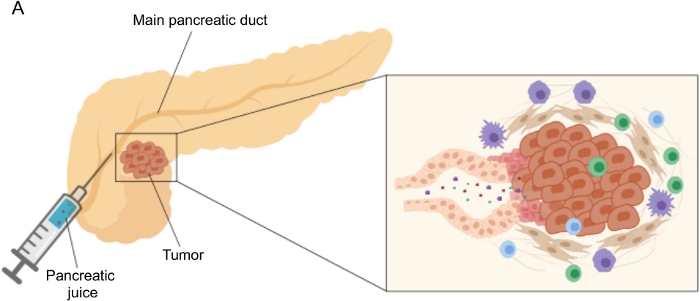
Abbildung 1: Schematische Darstellung der Pankreassaftsammlung. (A) Schematische Darstellung der Sekretion von Pankreassaft in den Pankreasgang und seiner Sammlung während der Operation. Der Einschub zeigt eine Nahaufnahme der Tumormikroumgebung: Pankreassaft sammelt Moleküle, die von Tumor- und Stromazellen in den Pankreasgängen freigesetzt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Sammlung von Pankreassaft in genetischen und orthotopen Mausmodellen von PDAC wäre in der Perspektive zu begrüßen, dieses Biofluid in präklinischen mechanistischen Studien zu nutzen; Dieses Verfahren kann jedoch technisch sehr anspruchsvoll sein und ist für einfachere Modelle wie subkutane Tumoren nicht realisierbar. Aus diesem Grund identifizierten wir Tumor-Interstitialflüssigkeit (TIF) als alternative Quelle zu Pankreassaft, da sie als Indikator für umgebende Störungen fungiert. Interstitielle Flüssigkeit (IF) ist die extrazelluläre Flüssigkeit, die sich außerhalb von Blut- und Lymphgefäßen befindet und Gewebezellen badet21. Die IF-Zusammensetzung wird sowohl durch die Durchblutung des Organs als auch durch die lokale Sekretion beeinflusst; Tatsächlich produzieren und sezernieren umgebende Zellen aktiv Proteine im IF21. Das Interstitium spiegelt mikroökologische Veränderungen des umgebenden Gewebes wider und könnte daher eine wertvolle Quelle für die Entdeckung von Biomarkern in verschiedenen pathologischen Kontexten wie Tumoren darstellen. Die hohe Konzentration lokal sezernierter Proteine in TIF kann verwendet werden, um Kandidatenmoleküle zu identifizieren, die als prognostische oder diagnostische Biomarker im Plasma22,23,24 getestet werden sollen. Mehrere Studien haben gezeigt, dass TIF eine geeignete Probe für proteomische Hochdurchsatzansätze ist, wie z. B. Massenspektrometrietechniken 23,24,25, sowie Multiplex-ELISA-Ansätze 26 und microRNA-Profiling 27.
Es wurden mehrere Ansätze für die Isolierung von IF in Tumoren vorgeschlagen, die grob kategorisiert werden können als di vivo (Kapillarultrafiltration 28,29,30,31 und Mikrodialyse 32,33,34,35) und ex vivo Methoden (Gewebezentrifugation 22,36,37,38 und Gewebeelution 39,40,41,42). Diese Techniken wurden ausführlich überprüft43,44. Bei der Wahl der geeigneten Methode sollten Aspekte wie die nachgelagerten Analysen und Anwendungen sowie das zurückgewonnene Volumen berücksichtigt werden. Wir haben diesen Ansatz kürzlich als Proof of Principle verwendet, um die unterschiedliche metabolische Aktivität von Tumoren aus zwei murinen Pankreas-Adenokarzinom-Zelllinienzu demonstrieren 12. Basierend auf Literatur 24,38 haben wir uns für die Verwendung der Low-Speed-Zentrifugationsmethode entschieden, um Zellbruch und Verdünnung durch intrazelluläre Inhalte zu vermeiden. Sowohl die Menge an Glukose als auch Laktat in TIF spiegelten die unterschiedlichen glykolytischen Eigenschaften der beiden verschiedenen Zelllinien wider. Hier beschreiben wir detailliert das Protokoll für die beiden am häufigsten verwendeten Methoden zur Isolierung von TIF: Gewebezentrifugation und Gewebeelution (Abbildung 2).
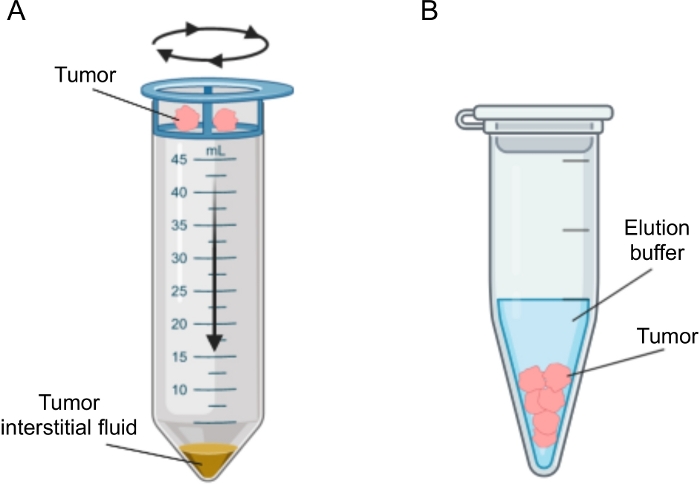
Abbildung 2: Schematische Darstellung der Methoden zur Isolierung der interstitiellen Tumorflüssigkeit. Schematische Darstellung der im Protokoll ausführlich beschriebenen Techniken, nämlich Gewebezentrifugation (A) und Gewebeelution (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
In dieser Studie haben wir die Technik zur intraoperativen Entnahme von Pankreassaft beschrieben, eine weitgehend unerforschte Flüssigkeitsbiopsie. Wir haben kürzlich gezeigt, dass Pankreassaft als Quelle für metabolische Marker der Krankheit genutzt werden kann12. Die metabolomische Analyse anderer Flüssigbiopsien wie Blut 5,6,7, Urin8 und Speichel9 hat vielversprechende Ergeb…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Wir danken Roberta Migliore für die technische Unterstützung. Die Forschung, die zu diesen Ergebnissen geführt hat, wurde von der Associazione Italiana per la ricerca sul cancro (AIRC) im Rahmen des Projekts IG2016-ID.18443 – P.I. Marchesi Federica – finanziert. Die Geldgeber hatten keine Rolle beim Studiendesign, der Datenerhebung und -analyse, der Entscheidung zur Veröffentlichung oder der Vorbereitung des Manuskripts.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Riferimenti
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Ricerca sul cancro. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

