בידוד של נוזלים פרוקסימליים כדי לחקור את המיקרו-סביבה של הגידול של אדנוקרצינומה של הלבלב
Summary
מיץ לבלב הוא מקור יקר של סמנים ביולוגיים לסרטן הלבלב האנושי. אנו מתארים כאן שיטה להליך איסוף תוך ניתוחי. כדי להתגבר על האתגר של אימוץ הליך זה במודלים של מורין, אנו מציעים דגימה חלופית, נוזל אינטרסטיציאלי של הגידול, ומתארים כאן שני פרוטוקולים לבידודו.
Abstract
אדנוקרצינומה של הלבלב (PDAC) היא הגורם הרביעי המוביל למוות הקשור לסרטן, ובקרוב תהפוך לשנייה. קיים צורך דחוף במשתנים הקשורים לפתולוגיות לבלב ספציפיות כדי לסייע באבחון דיפרנציאלי לפני הניתוח ובפרופיל המטופל. מיץ הלבלב הוא נוזל גוף שלא נחקר יחסית, אשר, בשל קרבתו לאתר הגידול, משקף שינויים ברקמה הסובבת. כאן אנו מתארים בפירוט את הליך האיסוף תוך ניתוחי. למרבה הצער, תרגום איסוף מיץ הלבלב למודלים של PDAC, לביצוע מחקרים מכניסטיים, הוא מאתגר מאוד מבחינה טכנית. הנוזל הבין-תאי של הגידול (TIF) הוא הנוזל החוץ-תאי, מחוץ לדם ולפלזמה, אשר שוטף את תאי הגידול והסטרומל. בדומה למיץ הלבלב, עבור התכונה שלו לאסוף ולרכז מולקולות שנמצאות מדולל בפלזמה, TIF יכול להיות מנוצל כאינדיקטור לשינויים מיקרו-סביבתיים וכמקור רב ערך של סמנים ביולוגיים הקשורים למחלות. מכיוון ש- TIF אינו נגיש בקלות, הוצעו טכניקות שונות לבידודו. אנו מתארים כאן שתי שיטות פשוטות ובלתי תובעניות מבחינה טכנית לבידודה: צנטריפוגה של רקמות והרחבת רקמות.
Introduction
אדנוקרצינומה של צינור הלבלב (PDAC) היא אחד הגידולים האגרסיביים ביותר, ובקרוב תהפוך לסיבתהמוות השנייה המובילה 1,2,3. הוא ידוע במיקרו-סביבה המדכאת את מערכת החיסון שלו ובחוסר התגובה שלו לפרוטוקולים אימונותרפיים4. נכון לעכשיו, כריתה כירורגית היא עדיין האפשרות המרפאת היחידה עבור PDAC, ובכל זאת יש תדירות גבוהה של הישנות מוקדמת וסיבוכים לאחר ניתוח. היעדר סימפטומים ספציפיים עד שלב מתקדם אינו מאפשר אבחון מוקדם, תורם למועדי המחלה. יתר על כן, החפיפה של הסימפטומים בין PDAC לבין פתולוגיות לבלב שפירות אחרות יכולה לעכב את ההישג של אבחנה מהירה ואמינה עם אסטרטגיות האבחון הנוכחיות. זיהוי משתנים הקשורים לפתולוגיות לבלב ספציפיות יכול להקל על תהליך קבלת ההחלטות הכירורגיות ולשפר את פרופיל המטופל.
תוצאות מבטיחות בגילוי סמנים ביולוגיים הושגו באמצעות נוזלי גוף נגישים בקלות, כגון דם 5,6,7, שתן 8, רוק9 ומיץ לבלב10,11,12. מחקרים רבים ניצלו גישות מקיפות של “אומיקה”, כגון טכניקות גנומיות, פרוטאומיות ומטבולומיות, כדי לזהות מולקולות או חתימות מועמדות שיכולות להבחין בין PDAC לבין פגיעות לבלב שפירות אחרות. לאחרונה הדגמנו כי ניתן להשתמש במיץ לבלב, נוזל גוף שטרם נחקר באופן יחסי, כדי לזהות חתימות מטבוליות של מטופלים עם פרופילים קליניים שונים12. מיץ הלבלב הוא נוזל עשיר בחלבון, אשר צובר את הפרשת תאי צינור הלבלב וזורם לצינור הלבלב הראשי, ולאחר מכן לצינור המרה המשותף העיקרי. בשל קרבתו ללבלב, הוא עשוי להיות מושפע מאוד מהפרעות מיקרו-סביבתיות המושרות על-ידי מסת הגידול (איור 1), ולכן הוא אינפורמטיבי יותר מדם או שתן, או פרופיל מבוסס רקמות. מספר מחקרים בחנו את הפוטנציאל של מיץ לבלב לזהות סמנים ביולוגיים חדשים של מחלות באמצעות גישות שונות, כולל ניתוח ציטולוגי 13, אנליזה פרוטאומית המבוצעת על ידי ספקטרומטריית מסה 14,15, הערכת סמנים גנטיים ואפיגנטיים כגון מוטציות K-ras ו-p53 16,17, שינויים במתילציה של DNA18, ו-miRNAs 19 . מבחינה טכנית, מיץ הלבלב ניתן לאסוף תוך ניתוחי או עם הליכים פולשניים מינימליים, כגון אולטרסאונד אנדוסקופי, cholangio-panracegraphy retrograde, או על ידי אוסף אנדוסקופי של הפרשת מיץ התריסריון20. עדיין לא ברור באיזו מידה הרכב מיץ הלבלב מושפע מטכניקת האיסוף המשמשת. אנו מתארים כאן את הליך האיסוף התוך-ניתוחי ומראים כי מיץ הלבלב יכול להוות מקור יקר ערך לסמנים ביולוגיים של PDAC.
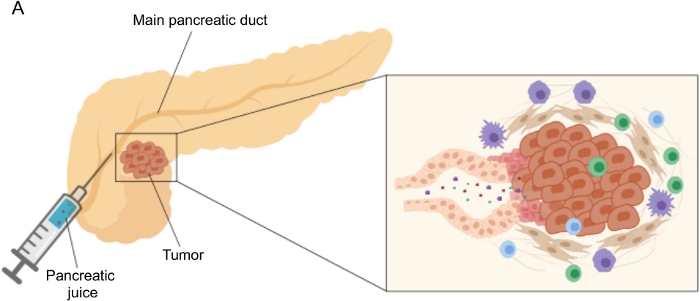
איור 1: ייצוג סכמטי של איסוף מיץ הלבלב. (A) ייצוג סכמטי המתאר את הפרשת מיץ הלבלב לצינור הלבלב ואיסופו במהלך הניתוח. הכניסה מראה תקריב של המיקרו-סביבה של הגידול: מיץ הלבלב אוסף מולקולות המשוחררות על ידי תאים סרטניים וסטרומליים בצינורות הלבלב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
אוסף מיץ הלבלב במודלים גנטיים ואורתוטופיים של עכברים PDAC יהיה מוערך בפרספקטיבה כדי לנצל את זה biofluid במחקרים מכניסטיים פרה-קליניים; עם זאת, הליך זה יכול להיות מאתגר מאוד מבחינה טכנית ואינו אפשרי עבור מודלים פשוטים יותר כגון גידולים תת עוריים. מסיבה זו, זיהינו נוזל אינטרסטיציאלי של הגידול (TIF) כמקור חלופי למיץ הלבלב, בגלל המאפיין הדומה שלו לפעול כאינדיקטור להפרעות בסביבה. נוזל אינטרסטיציאלי (IF) הוא הנוזל החוץ-תאי, הנמצא מחוץ לכלי הדם והלימפה, אשר שוטף תאי רקמה21. הרכב IF מושפע הן ממחזור הדם לאיבר והן מהפרשה מקומית; למעשה, התאים הסובבים מייצרים ומפרישים חלבונים באופן פעיל ב-IF21. האינטרסטיטיום משקף שינויים מיקרו-סביבתיים של הרקמות הסובבות ולכן יכול להוות מקור רב ערך לגילוי סמנים ביולוגיים במספר הקשרים פתולוגיים, כגון גידולים. הריכוז הגבוה של חלבונים מופרשים מקומית ב- TIF יכול לשמש לזיהוי מולקולות מועמדות להיבדק כסמנים ביולוגיים פרוגנוסטיים או אבחנתיים בפלזמה22,23,24. מספר מחקרים הוכיחו כי TIF הוא מדגם מתאים לגישות פרוטאומיות בעלות תפוקה גבוהה, כגון טכניקות ספקטרומטריית מסות23,24,25, כמו גם גישות ELISA מולטיפלקס26, ופרופיל מיקרו-רנ”א 27.
מספר גישות הוצעו לבידוד של IF בגידולים, אשר ניתן לסווג באופן רחב כמו di vivo (אולטרה סינון נימי 28,29,30,31 ומיקרודיאליזה 32,33,34,35) ושיטות ex vivo (צנטריפוגה רקמה 22,36,37,38 ו רקמות elution 39,40,41,42). טכניקות אלה נסקרו בפירוט רב43,44. הבחירה בשיטה המתאימה צריכה לקחת בחשבון סוגיות כגון ניתוחים ויישומים במורד הזרם והנפח שהתאושש. לאחרונה השתמשנו בגישה זו כהוכחה עקרונית כדי להדגים את הפעילות המטבולית השונה של גידולים משני קווי אדנוקרצינומה של לבלב12. בהתבסס על ספרות24,38, בחרנו להשתמש בשיטת הצנטריפוגה במהירות נמוכה כדי למנוע שבירה ודילול של תאים מתוכן תוך-תאי. גם כמות הגלוקוז וגם הלקטט ב-TIF שיקפו את המאפיינים הגליקוליטיים השונים של שני קווי התאים השונים. כאן נתאר בפירוט את הפרוטוקול של שתי השיטות הנפוצות ביותר לבידוד של TIF: צנטריפוגה של רקמות ואלוציה של רקמות (איור 2).
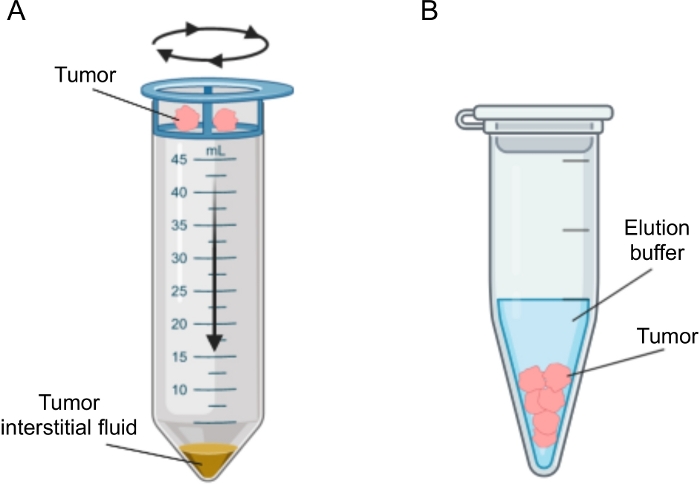
איור 2: ייצוג סכמטי של שיטות לבידוד נוזלים אינטרסטיציאליים של גידולים. המחשה סכמטית של הטכניקות המתוארות בפירוט בפרוטוקול, כלומר צנטריפוגה של רקמות (A) ואלקטרוגציה של רקמות (B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
במחקר זה תיארנו את הטכניקה לאיסוף תוך-ניתוחי של מיץ הלבלב, ביופסיה נוזלית שטרם נחקרה ברובה. לאחרונה הראינו כי מיץ הלבלב יכול להיות מנוצל כמקור סמנים מטבוליים של מחלה12. ניתוח מטבולי של ביופסיות נוזליות אחרות, כגון דם 5,6,7, שתן <su…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
אנו מודים לרוברטה מיליורה על הסיוע הטכני. המחקר שהוביל לתוצאות אלה קיבל מימון מ- Associazione Italiana per la ricerca sul cancro (AIRC) במסגרת פרויקט IG2016-ID.18443 – P.I. Marchesi Federica. למממנים לא היה כל תפקיד בתכנון המחקר, באיסוף הנתונים ובניתוחם, בהחלטה על הוצאתם לאור או בהכנת כתב היד.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Riferimenti
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Ricerca sul cancro. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

