Isolamento di fluidi prossimali per studiare il microambiente tumorale dell'adenocarcinoma pancreatico
Summary
Il succo pancreatico è una preziosa fonte di biomarcatori per il cancro del pancreas umano. Descriviamo qui un metodo per la procedura di raccolta intraoperatoria. Per superare la sfida di adottare questa procedura in modelli murini, suggeriamo un campione alternativo, il liquido interstiziale tumorale, e descriviamo qui due protocolli per il suo isolamento.
Abstract
L’adenocarcinoma pancreatico (PDAC) è la quarta causa di morte correlata al cancro e presto diventerà la seconda. Vi è un urgente bisogno di variabili associate a specifiche patologie pancreatiche per aiutare la diagnosi differenziale preoperatoria e la profilazione del paziente. Il succo pancreatico è un fluido corporeo relativamente inesplorato che, a causa della sua vicinanza al sito tumorale, riflette i cambiamenti nel tessuto circostante. Qui descriviamo in dettaglio la procedura di raccolta intraoperatoria. Sfortunatamente, tradurre la raccolta di succo pancreatico in modelli murini di PDAC, per eseguire studi meccanicistici, è tecnicamente molto impegnativo. Il liquido interstiziale tumorale (TIF) è il fluido extracellulare, al di fuori del sangue e del plasma, che bagna le cellule tumorali e stromali. Analogamente al succo pancreatico, per la sua proprietà di raccogliere e concentrare le molecole che si trovano diluite nel plasma, la TIF può essere sfruttata come indicatore di alterazioni microambientali e come preziosa fonte di biomarcatori associati alla malattia. Poiché la TIF non è facilmente accessibile, sono state proposte varie tecniche per il suo isolamento. Descriviamo qui due metodi semplici e tecnicamente poco impegnativi per il suo isolamento: la centrifugazione tissutale e l’eluizione tissutale.
Introduction
L’adenocarcinoma duttale pancreatico (PDAC) è uno dei tumori più aggressivi e presto diventerà la seconda causa di morte 1,2,3. È noto per il suo microambiente immunosoppressivo e per la sua scarsa risposta ai protocolli di immunoterapia4. Attualmente, la resezione chirurgica è ancora l’unica opzione curativa per il PDAC, ma c’è un’alta frequenza di recidive precoci e complicanze postchirurgiche. La mancanza di sintomi specifici fino a uno stadio avanzato non consente una diagnosi precoce, contribuendo alla scadenza della malattia. Inoltre, la sovrapposizione dei sintomi tra PDAC e altre patologie pancreatiche benigne può ostacolare il raggiungimento di una diagnosi tempestiva e affidabile con le attuali strategie diagnostiche. L’identificazione di variabili associate a specifiche patologie pancreatiche potrebbe facilitare il processo decisionale chirurgico e migliorare la profilazione del paziente.
Risultati promettenti nella scoperta di biomarcatori sono stati raggiunti utilizzando fluidi corporei facilmente accessibili, come sangue 5,6,7, urina8, saliva 9 e succo pancreatico10,11,12. Molti studi hanno sfruttato approcci “omici” completi, come tecniche genomiche, proteomiche e metabolomiche, per identificare molecole candidate o firme che potrebbero discriminare tra PDAC e altre afflizioni pancreatiche benigne. Abbiamo recentemente dimostrato che il succo pancreatico, un fluido corporeo relativamente inesplorato, può essere utilizzato per identificare le firme metaboliche di pazienti con profili clinici distinti12. Il succo pancreatico è un fluido ricco di proteine, che accumula il secretoma delle cellule duttali pancreatiche e scorre verso il dotto pancreatico principale e quindi verso il principale dotto biliare comune. A causa della sua vicinanza al pancreas, potrebbe essere fortemente influenzato dalle perturbazioni microambientali indotte dalla massa tumorale (Figura 1), e quindi più informativo del sangue o delle urine o della profilazione basata sui tessuti. Diversi studi hanno esplorato il potenziale del succo pancreatico per identificare nuovi biomarcatori di malattia utilizzando vari approcci, tra cui l’analisi citologica 13, l’analisi proteomica eseguita mediante spettrometria di massa 14,15, la valutazione di marcatori genetici ed epigenetici come K-ras e mutazioni p53 16,17, alterazioni nella metilazione del DNA 18 e miRNA 19 . Tecnicamente, il succo pancreatico può essere raccolto intraoperatoriamente o con procedure minimamente invasive, come l’ecografia endoscopica, la colangio-pancreatografia retrograda o mediante raccolta endoscopica della secrezione di succo duodenale20. Non è ancora chiaro in che misura la composizione del succo pancreatico sia influenzata dalla tecnica di raccolta utilizzata. Descriviamo qui la procedura di raccolta intraoperatoria e mostriamo che il succo pancreatico può rappresentare una fonte preziosa per i biomarcatori PDAC.
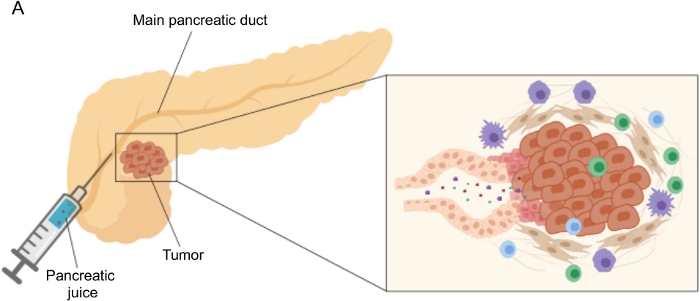
Figura 1: Rappresentazione schematica della raccolta del succo pancreatico. (A) Rappresentazione schematica raffigurante la secrezione di succo pancreatico nel dotto pancreatico e la sua raccolta durante l’intervento chirurgico. L’inserto mostra un primo piano del microambiente tumorale: il succo pancreatico raccoglie le molecole rilasciate dalle cellule tumorali e stromali nei dotti pancreatici. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La raccolta di succo pancreatico in modelli murini genetici e ortotopici di PDAC sarebbe apprezzata nella prospettiva di sfruttare questo biofluido in studi meccanicistici preclinici; Tuttavia, questa procedura può essere tecnicamente molto impegnativa e non è fattibile per modelli più semplici come i tumori sottocutanei. Per questo motivo, abbiamo identificato il liquido interstiziale tumorale (TIF) come fonte alternativa al succo pancreatico, per la sua caratteristica simile di agire come indicatore delle perturbazioni circostanti. Il liquido interstiziale (IF) è il liquido extracellulare, che si trova al di fuori del sangue e dei vasi linfatici, che bagna le cellule dei tessuti21. La composizione di IF è influenzata sia dalla circolazione sanguigna all’organo che dalla secrezione locale; infatti, le cellule circostanti producono e secernono attivamente proteine nell’IF21. L’interstizio riflette i cambiamenti microambientali dei tessuti circostanti e potrebbe quindi rappresentare una preziosa fonte per la scoperta di biomarcatori in diversi contesti patologici, come i tumori. L’alta concentrazione di proteine localmente secrete in TIF può essere utilizzata per identificare molecole candidate da testare come biomarcatori prognostici o diagnostici nel plasma22,23,24. Diversi studi hanno dimostrato che TIF è un campione adatto per approcci proteomici ad alto rendimento, come le tecniche di spettrometria di massa 23,24,25, così come gli approcci ELISA multiplex 26 e il profilo dei microRNA 27.
Sono stati proposti diversi approcci per l’isolamento dell’IF nei tumori, che possono essere ampiamente classificati come metodi in vivo (ultrafiltrazione capillare 28,29,30,31 e microdialisi 32,33,34,35) ed ex vivo (centrifugazione tissutale 22,36,37,38 e eluizione tissutale 39,40,41,42). Queste tecniche sono state esaminate in dettaglio 43,44. La scelta del metodo appropriato dovrebbe tenere conto di aspetti quali le analisi e le applicazioni a valle e il volume recuperato. Recentemente abbiamo usato questo approccio come prova di principio per dimostrare la diversa attività metabolica dei tumori da due linee cellulari di adenocarcinoma pancreatico murino12. Sulla base della letteratura24,38, abbiamo scelto di utilizzare il metodo di centrifugazione a bassa velocità per evitare la rottura e la diluizione delle cellule dal contenuto intracellulare. Sia la quantità di glucosio che di lattato in TIF riflettevano le diverse caratteristiche glicolitiche delle due diverse linee cellulari. Qui descriviamo in dettaglio il protocollo per i due metodi più comunemente usati per l’isolamento della TIF: centrifugazione tissutale ed eluizione tissutale (Figura 2).
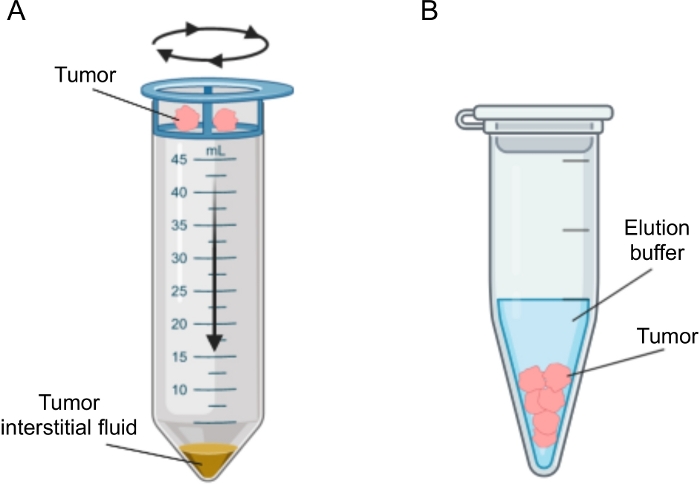
Figura 2: Rappresentazione schematica dei metodi di isolamento del liquido interstiziale tumorale. Illustrazione schematica delle tecniche descritte in dettaglio nel protocollo, vale a dire centrifugazione tissutale (A) ed eluizione tissutale (B). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
In questo studio abbiamo descritto la tecnica per raccogliere intraoperatoriamente il succo pancreatico, una biopsia fluida in gran parte inesplorata. Abbiamo recentemente dimostrato che il succo pancreatico può essere sfruttato come fonte di marcatori metabolici della malattia12. L’analisi metabolomica su altre biopsie liquide, come sangue 5,6,7, urina8 e saliva9,<sup class="xref…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Si ringrazia Roberta Migliore per l’assistenza tecnica. La ricerca che ha portato a questi risultati ha ricevuto finanziamenti dall’Associazione Italiana per la ricerca sul cancro (AIRC) nell’ambito del progetto IG2016-ID.18443 – P.I. Marchesi Federica. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Riferimenti
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Ricerca sul cancro. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

