무세포 재구성을 위한 재조합 셉틴 복합체의 정제 및 품질 관리
Summary
세포골격 단백질의 체외 재구성은 이러한 단백질의 기본 기능적 특성을 이해하는 데 필수적인 도구입니다. 본 논문은 세포 분열 및 이동에 중심적인 역할을 하는 재조합 셉틴 복합체의 품질을 정제하고 평가하는 프로토콜을 설명합니다.
Abstract
Septins는 헤테로 올리고머 복합체로부터 세포 골격 필라멘트와 고차 구조를 형성 할 수있는 보존 된 진핵 생물 GTP 결합 단백질 계열입니다. 그들은 다른 세포 골격 구성 요소 및 세포막과 상호 작용하여 이동 및 세포 분열과 같은 중요한 세포 기능에 참여합니다. 셉틴의 많은 상호 작용의 복잡성, 많은 수의 셉틴 유전자(인간의 경우 13개) 및 셉틴이 다른 서브유닛 구성을 가진 헤테로-올리고머 복합체를 형성하는 능력으로 인해 무세포 재구성은 셉틴 생물학의 기초를 이해하는 데 중요한 전략입니다. 본 논문은 먼저 2단계 친화성 크로마토그래피 접근법을 사용하여 재조합 셉틴을 그의 헤테로올리고머 형태로 정제하는 방법을 설명한다. 그런 다음 셉틴 복합체의 순도와 무결성을 확인하는 데 사용되는 품질 관리 프로세스가 자세히 설명되어 있습니다. 이 공정은 네이티브 및 변성 겔 전기 영동, 음성 염색 전자 현미경 및 간섭계 산란 현미경을 결합합니다. 마지막으로, 음성염색전자현미경과 형광현미경을 이용하여 셉틴 복합체의 중합능을 확인하는 과정에 대한 설명이 주어진다. 이것은 초파리 셉틴 헥사머뿐만 아니라 다양한 이소 형태의 septin_9 포함하는 고품질의 인간 셉틴 헥사 머 및 옥타 머를 생산할 수 있음을 보여줍니다.
Introduction
세포 골격은 고전적으로 액틴 필라멘트, 미세 소관 및 중간 필라멘트 1로 구성된 3 성분 시스템으로 설명되었지만 최근에는 셉틴이 세포 골격1의 네 번째 구성 요소로 인정되었습니다. 셉틴은 진핵생물2에서 보존되는 GTP 결합 단백질 계열입니다. 셉틴은 세포 분열3, 세포-세포 부착4, 세포 운동성5, 형태형성6, 세포 감염7, 세포 극성의 확립 및 유지8와 같은 많은 세포 기능에 관여합니다. 중요한 기능에도 불구하고 셉틴이 그러한 과정에 어떻게 관여하는지는 잘 이해되지 않습니다.
단백질의 셉틴 계열은 단백질 서열 유사성2에 따라 여러 하위 그룹 (분류에 따라 4 개 또는 7 개)으로 세분됩니다. 상이한 서브패밀리의 구성원은 회문 헤테로-올리고머 복합체를 형성할 수 있으며, 이는 필라멘트의 빌딩 블록이며, 이는 차례로 번들, 링 및 메쉬웍스 1,9,10,11,12와 같은 고차 구조로 조립됩니다. 더 많은 분자 복잡성은 상이한 스플라이스 변이체의 존재로부터 발생하며, 예를 들어 인간 SEPT9가 있으며, 여기서 상이한 스플라이스 변이체13,14,15의 특정 기능에 대한 증거가 존재한다. 추가적으로, 헤테로올리고머의 길이는 종 및 세포 유형에 의존한다. 예를 들어, Caenorhabditis elegans septins는 사량 체16을 형성하고, Drosophila melanogaster septins는 헥사 머 17 (그림 1A), 사카로 미세스 cerevisiae 셉틴은 옥타 머 18을 형성하고, 인간 셉틴은 헥사 머 및 옥타머19 (그림 1A)를 형성합니다. 동일한 서브패밀리로부터의 셉틴 이소형, 스플라이스 변이체 및 번역 후 변형된 셉틴이 복합체에서 서로를 대체하는 능력 및 상이한 크기의 헤테로-올리고머의 (공존)존재는 상이한 헤테로-올리고머 복합체12의 세포 기능을 묘사하는 것을 어렵게 만들었다.
셉틴의 또 다른 흥미로운 능력은 세포의 많은 결합 파트너와 상호 작용하는 능력입니다. Septins는 간기 및 세포 분열20,21,22 동안 원형질막과 막 세포 소기관에 결합합니다. 분열하는 세포에서 셉틴은 세포질 분열23,24,25 및 액틴 및 미오신 26,27과 협력합니다. 세포질 분열의 후기 단계에서, 셉틴은 중체 이탈28에 대한 수송 (ESCRT) 시스템에 필요한 엔도솜 분류 복합체를 조절하는 것으로 보인다. 또한, 액틴 피질에 위치한 셉틴과 간기 세포 29,30,31에서 세포의 액틴 스트레스 섬유의 증거도 있습니다. 특정 세포 유형에서, 셉틴은 또한 미세소관 세포골격(32,33)에 결합하고 조절한다.
이러한 모든 기능으로 인해 셉틴은 연구하기에 매우 흥미로운 단백질 시스템이지만 도전적인 시스템이기도 합니다. 많은 수의 셉틴 서브 유닛 (스플 라이스 변이체를 계산하지 않고 인간의 13 개 유전자2)과 동일한 서브 패밀리의 셉틴 서브 유닛이 서로를 대체하고 다른 크기의 헤테로 올리고머를 형성 할 가능성의 조합은 유전자 조작에 의한 특정 셉틴의 세포 기능에 대한 결론을 도출하는 것을 어렵게 만든다. 또한, 셉틴의 다중 상호 작용은 세포 골격 또는 막 구성 요소를 대상으로 하는 약물34 와 같은 일반적인 연구 도구의 효과를 해석하는 것을 어려운 작업으로 만듭니다.
이러한 상황을 극복하는 방법은 셉틴의 시험관 내 (무 세포) 재구성으로 세포 연구를 보완하는 것입니다. 시험관 내 재구성은 특정 서브 유닛 조성 및 길이 18,35,36,37을 갖는 단일 유형의 셉틴 헤테로 올리고머의 분리를 허용한다. 그런 다음이 복합체는 셉틴38,39,40의 기본 구조적 및 물리 화학적 특성을 발견하기 위해 단독으로 또는 모델 생물막 11,41,42, 액틴 필라멘트 10,27 또는 미세 소관32,36과 같은 원하는 파트너와 함께 제어 된 환경에서 연구하여 특성을 해독 할 수 있습니다. 상호 작용.
따라서 다양한 셉틴 복합체를 효율적으로 정제하는 신뢰할 수 있는 방법은 셉틴 연구에 필수적입니다. 그러나 동일한 프로토콜을 사용하더라도 다른 정제는 다른 활성/기능 또는 무결성을 가진 단백질을 제공할 수 있습니다. 효소와 같은 상업적으로 이용 가능한 단백질의 경우, 기능성 및 효소 활성이 신중하게 검증된다43. 세포골격 또는 셉틴과 같은 구조 단백질에 대한 신중한 품질 관리를 구현하는 것은 어려울 수 있지만 실험실 간 실험을 비교할 수 있도록 하는 것이 중요합니다.
이 논문은 대장균 세포에서 단일 또는 이중 시스트로닉 구축물을 포함하는 두 벡터의 동시 발현(표 1)을 기반으로 고품질 재조합 셉틴을 이종 올리고머 형태로 정제하는 강력한 방법을 설명합니다. 이 방법은 그의6-태그된 셉틴과 Strep-II-태그된 셉틴을 모두 포함하는 셉틴 헤테로올리고머를 포획하기 위한 2단계 친화성 크로마토그래피 접근법으로 구성됩니다(그림 1B,C). Iv et al.10에 처음 기술된 이 프로토콜은 초파리 셉틴 헥사머 11,27,35, 인간 셉틴 헥사 머 10 및 상이한 천연(이소형 1, 3 및 5)10,32 또는 돌연변이된 SEPT9 이소폼 32를 함유하는 여러 인간 셉틴 옥타머를 정제하는 데 사용되었습니다. . 또한, 정제된 셉틴의 품질을 평가하기 위한 일련의 기술에 대한 설명이 제공된다. 먼저, 셉틴 서브 유닛의 완전성과 정확한 화학 양 론은 변성 전기 영동 및 투과 전자 현미경 (TEM)을 사용하여 확인됩니다. 그런 다음 정확한 분자량의 헤테로 올리고머의 존재와 복잡한 불안정성을 나타내는 단량체 또는 더 작은 올리고머의 존재를 간섭계 산란 현미경(iSCAT)을 통한 기본 전기영동 및 질량 광도법으로 검사합니다. 마지막으로, 마지막 단계는 형광 현미경 및 TEM을 사용하여 셉틴의 중합 활성을 평가하는 것으로 구성됩니다.
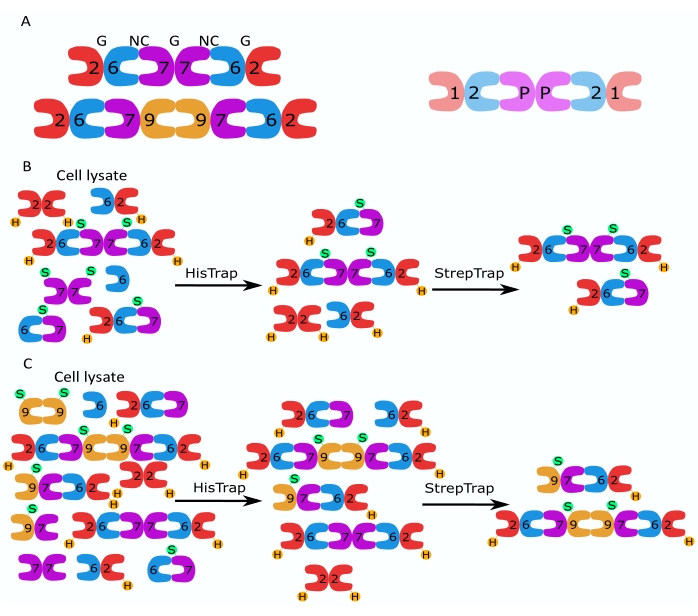
그림 1: 정제 전략 . (A) 인간(왼쪽)과 초파리 (오른쪽) 세포에 존재하는 셉틴 헤테로올리고머의 도식. 숫자는 표시된 그룹의 셉틴 하위 단위를 나타내고 P는 땅콩을 나타냅니다. 인간 SEPT9는 그의 이소형일 수 있다. 셉틴 서브 유닛은 비대칭 모양을 가지며 인간 육각 체 위에 각각 NC 및 G로 표시된대로 두 개의 별개의 인터페이스 인 NC : NC 및 G : G 인터페이스와 길이 방향으로 연결됩니다. (ᄃ,씨) (B) 인간 셉틴 헥사머 및 (C) 옥타머에 대해 표시된 2단계 크로마토그래피 전략의 개략도. H는 그의 태그를 나타내고 S는 스트렙-II 태그를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
여기에 설명된 방법은 사전 형성된 셉틴 헤테로올리고머의 강력한 정제 및 품질 관리를 가능하게 합니다. 이 방법의 올바른 적용을 위해 고려해야 할 몇 가지 주요 문제는 다음과 같습니다. 크로마토그래피 분리의 용리 단계 중에 셉틴 복합체의 희석을 최소화하기 위해 권장(또는 더 낮은) 유속을 사용하는 것이 중요합니다. 또한 최종 농축 단계에서 단백질 회수를 최대화하기 위해 농축기 컬럼은 용액이 필터에 밀려나지 않는 방식으로 배향됩니다(한쪽에만 필터가 있는 경우). 용액이 필터로 직접 이동하면 단백질이 필터에 훨씬 더 달라 붙어 최종 수율이 크게 감소합니다. 농축 단계가 항상 필요한 것은 아니라는 점을 고려하는 것도 중요합니다. 크로마토그램의 피크 주변의 좁은 범위에서만 분획을 선택하는 것은 일반적으로 많은 재구성 응용 분야(일반적으로 10-300nM 사이에서 작동)에 대해 충분히 높은 스톡 농도(>3,000nM)를 제공합니다. 마지막으로, 형광 현미경에 의한 셉틴 복합체의 기능성을 품질 제어하기 위해서는 셉틴 복합체가 유리에 열렬히 달라 붙기 때문에 현미경 슬라이드의 표면을 올바르게 부동 태화하는 것이 중요합니다. 유리 슬라이드의 패시베이션은 PLL-PEG 기능화 또는 중성(100% DOPC) 지지된 지질 이중층(11,32)의 형성에 의해 수행될 수 있다.
Iv et al.10에 처음 기술된 원래의 정제 프로토콜과 비교하여, 완충액 조성에 변화가 있다(표 2). MgCl2의 농도는 5mM에서 2mM로 감소하였고, Tris-HCl의 농도 및 pH는 각각 50mM에서 20mM 및 8.0에서 7.4로 감소하였다. 이러한 변경은 완충 조건을 인간 셉틴과 지질 이중층, 액틴 필라멘트 및 미세 소관10,11,32의 상호 작용에 대한 연구와 양립 할 수 있도록하기 위해 이루어졌습니다. 이는 저자들이 F- 완충액에 ATP가 존재하는 것을 제외하고는 darkSPB의 조성과 동일한 F- 완충액에서 지지된 지질 이중층과 중합 된 액틴을 형성했기 때문입니다. 완충액 변화는 원래 완충액과 비교하여 정제된 셉틴의 품질 또는 수명에 어떠한 변화도 일으키지 않았다.
이 정제 방법에는 여전히 몇 가지 한계가 있습니다. 첫째, 상이한 정제 시도는 정제된 셉틴 복합체의 번들 형성 능력에 의해 확인된 바와 같이 수율(2-5μM 셉틴 복합체의 0.5-1mL) 및 기능적 품질에서 다양할 수 있다. 그렇기 때문에 이 백서에 설명된 품질 검사를 일관되게 수행하는 것이 매우 중요합니다. 박테리아 배양의 발현 시간과 광학 밀도를 매우 잘 제어하면 수율 차이를 완화하는 데 도움이 될 수 있습니다. 둘째, 이 정제 파이프라인은 삼량체와 헥사머 또는 사량체와 옥타머를 구별할 수 없습니다(그림 1B). 그러나, 품질 관리 실험은 셉틴 복합체의 대다수가 그들의 긴 올리고머 형태임을 증명하기 위해 사용될 수 있다. 더 좁은 올리고머 크기 분포가 필요한 경우 1.6단계 사이에 크기 배제 크로마토그래피를 삽입할 수 있습니다. 및 단계 1.7. 정제 프로토콜의. 그러나 이 선택적 단계는 수율을 크게 감소시키며 꼭 필요한 경우가 아니면 권장되지 않습니다. 마지막으로, 보다 근본적인 한계는 재조합 셉틴 복합체의 발현 시스템으로 대장균을 사용하는 것에서 비롯됩니다. 당연히이 시스템은 인산화, 아세틸 화 및 수모 일화 6,51,52,53과 같은 동물 세포에서보고 된 번역 후 변형 (PTM)을 허용하지 않습니다. 이러한 번역 후 변형은 곤충 또는 인간 세포에서 유사한 정제 전략을 구현함으로써 추가 될 수 있습니다. 또한, 이 논문은 셉틴의 재구성 자체에 대해서만 논의했지만, 세포에 대한 연구에 따르면 Borg 계열 54,55 및 아닐린24,25,56의 단백질과 같은 조절 단백질은 셉틴의 조립 및 기능에 실질적이지만 잘 이해되지 않은 영향을 미칠 수 있으므로 결국 체외에서 통합하는 것이 중요합니다. 연구. Borg 단백질 및 아닐린의 정제를 위한 프로토콜은54,57로 보고되었다.
여기에 보고된 셉틴 정제 프로토콜은 올바른 서브유닛 화학량론을 사용하여 올리고머 형태의 셉틴을 정제하는 표준화된 방법을 제공하여 단일 셉틴 서브유닛에 의존하는 많은 초기 시험관 내 연구에 비해 중요한 발전을 제공합니다. 특정 상황에서 일부 셉틴이 단일서브유닛2으로 작용할 수 있지만, 현재의 문헌은 동물 세포에서 셉틴이 대부분 복합체 9,58에서 기능한다는 것을 강력하게 시사합니다. 따라서, 이 논문 및 기타 10,11,18,32,35,36,37에 기술된 것과 같은 미리 형성된 헤테로-올리고머의 사용은 in vitro를 통해 셉틴의 구조적 및 생물물리학적 특성을 연구하는 데 매우 중요합니다. 세포에서 기능을 해부하기위한 재구성. 또한, 셉틴은 막과 세포 골격을 포함한 많은 상호 작용 파트너를 가진 자기 조립 단백질이므로 상향식 합성 생물학59,60,61 및 곡률42,62,63과 같은 막 생물 물리학 적 특성의 단백질 유도 변화에 대한 연구에 큰 관심을 끌고 있습니다.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
질량 측광(iSCAT) 실험에 도움을 준 Cecilia de Agrela Pinto, Tomás de Garay, Katharina Häußermann에게 감사드립니다. 아르옌 야코비와 윌 에버스가 TEM에 도움을 주었습니다. TIRF에 대한 그녀의 도움을 주신 루시아 발다우프; 파스칼 베르디에 – 피나르 (Pascal Verdier-Pinard)는 네이티브 전기 영동에 관한 조언을 해주었습니다. Agata Szuba와 Marjolein Vinkenoog는 Drosophila septin 정제 노력과 프랑스 국립 연구 인프라 France-BioImaging (ANR10-INBS-04)의 회원인 Institut Curie의 Cell and Tissue Imaging (PICT-IBiSA)을 설정하는 데 도움을 주었습니다. 이 연구는 ‘BaSyC-합성 세포 구축’ 중력 보조금(024.003.019)을 통해 네덜란드 과학 연구 기구(NWO/OCW)와 Agence Nationale pour la Recherche(ANR 보조금 ANR-17-CE13-0014: “SEPTIMORF”; ANR-13-JSV8-0002-01: “9월”; 및 ANR-20-CE11-0014-01: “SEPTSCORT”).
Materials
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger – enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger – reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Riferimenti
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802 (2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349 (2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76 (2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203 (2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226 (2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190 (2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -. C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420 (2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315 (2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).

