Rening och kvalitetskontroll av rekombinanta septinkomplex för cellfri beredning
Summary
In vitro-rekonstitution av cytoskelettproteiner är ett viktigt verktyg för att förstå de grundläggande funktionella egenskaperna hos dessa proteiner. Denna uppsats beskriver ett protokoll för att rena och bedöma kvaliteten på rekombinanta septinkomplex, som spelar en central roll i celldelning och migration.
Abstract
Septiner är en familj av konserverade eukaryota GTP-bindande proteiner som kan bilda cytoskelettfilament och högre ordningsstrukturer från hetero-oligomera komplex. De interagerar med andra cytoskelettkomponenter och cellmembranet för att delta i viktiga cellulära funktioner som migration och celldelning. På grund av komplexiteten i septinernas många interaktioner, det stora antalet septingener (13 hos människor) och septinernas förmåga att bilda hetero-oligomera komplex med olika subenhetskompositioner, är cellfri rekonstitution en viktig strategi för att förstå grunderna i septinbiologi. Denna uppsats beskriver först en metod för att rena rekombinanta septiner i deras hetero-oligomera form med hjälp av en tvåstegs affinitetskromatografimetod. Därefter beskrivs processen för kvalitetskontroll som används för att kontrollera renheten och integriteten hos septinkomplexen. Denna process kombinerar inbyggd och denaturerande gelelektrofores, negativ fläckelektronmikroskopi och interferometrisk spridningsmikroskopi. Slutligen ges en beskrivning av processen för att kontrollera polymerisationsförmågan hos septinkomplex med användning av negativ fläckelektronmikroskopi och fluorescerande mikroskopi. Detta visar att det är möjligt att producera högkvalitativa humana septinhexamerer och oktamerer som innehåller olika isoformer av septin_9, liksom Drosophila septinhexamerer.
Introduction
Cytoskelettet har klassiskt beskrivits som ett trekomponentsystem bestående av aktinfilament, mikrotubuli och mellanliggande filament 1, men nyligen har septiner erkänts som en fjärde komponent i cytoskeletten1. Septiner är en familj av GTP-bindande proteiner som bevaras i eukaryoter2. Septiner är involverade i många cellulära funktioner såsom celldelning3, cell-celladhesion4, cellmotilitet5, morfogenes6, cellulär infektion7 och etablering och underhåll av cellpolaritet8. Trots deras viktiga funktioner är hur septiner är involverade i sådana processer dåligt förstådda.
Septinfamiljen av proteiner är indelad i flera undergrupper (fyra eller sju, beroende på klassificeringen) baserat på proteinsekvenslikhet2. Medlemmar av olika underfamiljer kan bilda palindromiska hetero-oligomera komplex, som är byggstenarna i filament och som i sin tur monteras i högre ordningsstrukturer såsom buntar, ringar och nätverk 1,9,10,11,12. Ytterligare molekylär komplexitet uppstår genom närvaron av olika skarvvarianter, ett exempel är human SEPT9, där det finns bevis för specifika funktioner hos olika skarvvarianter13,14,15. Dessutom beror längden på hetero-oligomererna på art och celltyp. Till exempel bildar Caenorhabditis elegans septiner tetramerer16, Drosophila melanogaster septiner bildar hexamerer 17 (figur 1A), Saccharomyces cerevisiae septiner bildar oktamerer18 och mänskliga septiner bildar både hexamerer och oktamerer19 (figur 1A). Förmågan hos septinisoformer, skarvvarianter och post-translationellt modifierade septiner från samma underfamilj att ersätta varandra i komplexet och (sam)existensen av hetero-oligomerer av olika storlek har gjort det svårt att avgränsa cellfunktionerna hos olika hetero-oligomera komplex12.
En annan intressant förmåga hos septiner är deras förmåga att interagera med många bindande partners i cellen. Septiner binder plasmamembranet och membranorganellerna under interfas och celldelning20,21,22. I delande celler samarbetar septiner med anillin 23,24,25 och aktin och myosin under cytokinese 26,27. I de sena stadierna av cytokinese verkar septiner reglera de endosomala sorteringskomplexen som krävs för transportsystemet (ESCRT) för abscission av mellankroppen28. Dessutom finns det också bevis på septin som ligger på aktinbarken och aktinstressfibrerna i celler i interfasceller 29,30,31. I specifika celltyper binder och reglerar septiner också mikrotubulicytoskelettet32,33.
Alla dessa funktioner gör septiner till ett mycket intressant proteinsystem att studera, men också ett utmanande. Kombinationen av det stora antalet septinunderenheter (13 gener hos människor utan att räkna skarvvarianter2) med potentialen hos septinunderenheter från samma underfamilj att ersätta varandra och bilda hetero-oligomerer av olika storlek gör det svårt att dra en slutsats om cellfunktionen hos en specifik septin genom genetisk manipulation. Dessutom gör de många interaktionerna mellan septiner att tolka effekterna av vanliga forskningsverktyg som läkemedel34 riktade mot cytoskelett- eller membrankomponenter till en svår uppgift.
Ett sätt att övervinna denna situation är att komplettera forskningen i celler med in vitro (cellfri) rekonstituering av septiner. In vitro-rekonstitution möjliggör isolering av en enda typ av septin hetero-oligomerer med en specifik subenhetssammansättning och längd 18,35,36,37. Detta komplex kan sedan studeras i en kontrollerad miljö, antingen ensam för att upptäcka de grundläggande strukturella och fysikalisk-kemiska egenskaperna hos septiner 38,39,40, eller i kombination med önskade partners såsom modellbiomembraner 11,41,42, aktinfilament 10,27 eller mikrotubuli 32,36 för att dechiffrera arten av deras Interaktioner.
Därför är en pålitlig metod för att rena olika septinkomplex effektivt avgörande för septinforskning. Men även med samma protokoll kan olika reningar ge proteiner med olika aktivitet/funktionalitet eller till och med integritet. För kommersiellt tillgängliga proteiner såsom enzymer valideras funktionaliteten och den enzymatiska aktiviteten noggrant43. Att genomföra noggrann kvalitetskontroll för cytoskelettala eller strukturella proteiner som septiner kan vara utmanande, men det är viktigt att göra experiment över laboratorier jämförbara.
Denna uppsats beskriver en robust metod för att rena högkvalitativa rekombinanta septiner i deras hetero-oligomera form baserat på samtidig expression av två vektorer innehållande mono- eller bi-cistroniska konstruktioner (tabell 1) i Escherichia coli-celler. Metoden består av en tvåstegs affinitetskromatografimetod för att fånga septin hetero-oligomerer innehållande både enhans 6-taggade septin och en Strep-II-taggad septin (figur 1B,C). Detta protokoll, som först beskrevs i Iv et al.10, har använts för att rena Drosophila septinhexamerer 11,27,35, humana septinhexamerer 10 och flera humana septinoktamerer som innehåller olika infödda (isoform 1, 3 och 5)10,32 eller muterade SEPT9-isoformer 32 . Vidare ges en beskrivning av en uppsättning tekniker för att bedöma kvaliteten på de renade septinerna. Först kontrolleras integriteten och den korrekta stökiometrin hos septinunderenheterna med hjälp av denatureringselektrofores och transmissionselektronmikroskopi (TEM). Därefter undersöks närvaron av hetero-oligomerer med rätt molekylmassa och närvaron av monomerer eller mindre oligomerer som indikerar komplex instabilitet genom inbyggd elektrofores och massfotometri via interferometrisk spridningsmikroskopi (iSCAT). Slutligen består det sista steget av bedömningen av septinernas polymeriserande aktivitet med användning av fluorescensmikroskopi och TEM.
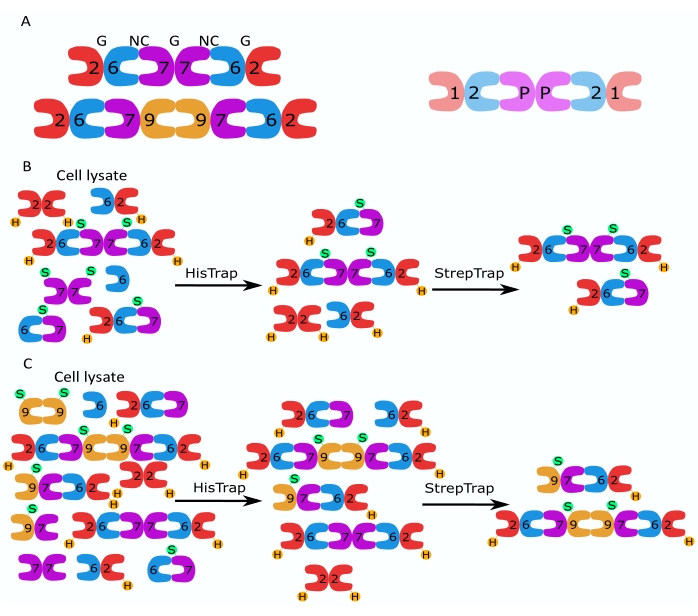
Figur 1: Reningsstrategi . (A) Scheman för septin hetero-oligomerer som finns i mänskliga (vänster) och Drosophila (höger) celler. Siffror betecknar septinunderenheter från de angivna grupperna, och P betecknar jordnöt. Mänsklig SEPT9 kan vara någon av dess isoformer. Septinunderenheterna har en asymmetrisk form och är längsgående associerade med två distinkta gränssnitt, NC: NC och G: G-gränssnittet, som betecknas med NC respektive G, ovanpå den mänskliga hexameren. (B,C) Schematisk illustration av tvåstegskromatografistrategin, visad för (B) humana septinhexamerer och (C) oktamerer. H anger his-taggarna, medan S anger Strep-II-taggarna. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Metoden som beskrivs här möjliggör robust rening och kvalitetskontroll av förformade septin hetero-oligomerer. Några av de viktigaste frågorna att tänka på för korrekt tillämpning av metoden är följande. Under elueringsstegen i de kromatografiska separationerna är det viktigt att använda den rekommenderade (eller lägre) flödeshastigheten för att minimera utspädningen av septinkomplexen. För att maximera återhämtningen av protein under det slutliga koncentrationssteget är koncentratorkolonnen dessutom orienterad på ett sådant sätt att lösningen inte skjuts mot filtret (när det bara finns ett filter på ena sidan). Om lösningen går direkt till filtret, fastnar proteinet mycket mer på det, vilket väsentligt minskar det slutliga utbytet. Det är också viktigt att tänka på att koncentrationssteget inte alltid är nödvändigt. Att endast plocka fraktioner från ett smalt område runt toppen i kromatogrammet ger vanligtvis en tillräckligt hög lagerkoncentration (>3 000 nM) för många rekonstitueringsapplikationer (som vanligtvis arbetar mellan 10-300 nM). Slutligen, för kvalitetskontroll av septinkomplexens funktionalitet genom fluorescensmikroskopi, är det viktigt att korrekt passivera ytan på mikroskopiglasen, eftersom septinkomplex håller fast vid glas. Passivering av glasskivorna kan göras antingen via PLL-PEG-funktionalisering eller genom bildandet av neutrala (100% DOPC) stödda lipid-dubbelskikt11,32.
Jämfört med det ursprungliga reningsprotokollet som först beskrevs i Iv et al.10 sker en förändring i buffertkompositionerna (tabell 2). Koncentrationen av MgCl2 har sänkts från 5 mM till 2 mM, och koncentrationen och pH för Tris-HClhar sänkts från 50 mM till 20 mM respektive från 8,0 till 7,4. Dessa förändringar gjordes för att göra buffertförhållandena kompatibla med studier av interaktioner mellan humana septiner och lipid-dubbelskikt, aktinfilament och mikrotubuli10,11,32. Detta beror på att författarna bildade stödda lipid-dubbelskikt och polymeriserat aktin i F-bufferten, vars sammansättning är identisk med darkSPB, förutom närvaron av ATP i F-bufferten. Buffertförändringen gav inga förändringar i kvaliteten eller livslängden på de renade septinerna jämfört med de ursprungliga buffertarna.
Denna reningsmetod har fortfarande flera begränsningar. För det första kan olika reningsförsök variera i utbyte (0,5-1 ml 2-5 μM septinkomplex) och funktionell kvalitet, vilket kontrolleras av buntbildningsförmågan hos de renade septinkomplexen. Det är därför det är mycket viktigt att konsekvent utföra de kvalitetskontroller som beskrivs i detta dokument. Att kontrollera mycket bra uttryckstiderna och den optiska densiteten hos bakteriekulturen kan hjälpa till att mildra skillnaden i utbyte. För det andra kan denna reningsledning inte skilja mellan trimers och hexamerer eller mellan tetramerer och oktamerer (figur 1B). Kvalitetskontrollexperimenten kan emellertid användas för att bevisa att majoriteten av septinkomplexen är i sin långa oligomerform. Om en ännu smalare oligomerstorleksfördelning krävs kan storleksuteslutningskromatografi infogas mellan steg 1.6. och steg 1.7. av reningsprotokollet. Detta valfria steg minskar dock dramatiskt avkastningen, och det rekommenderas inte om det inte är absolut nödvändigt. En sista, mer grundläggande, begränsning kommer från användningen av E. coli som ett uttryckssystem för rekombinanta septinkomplex. Naturligtvis tillåter detta system inte post-translationella modifieringar (PTM), som har rapporterats i djurceller, såsom fosforylering, acetylering och sumoylering 6,51,52,53. Dessa posttranslationella modifieringar kan läggas till genom att implementera en liknande reningsstrategi i insekts- eller mänskliga celler. Dessutom har detta dokument bara diskuterat rekonstitueringen av septiner i sig, men studier i celler indikerar att regulatoriska proteiner som proteiner från Borg-familjen 54,55 och anillin 24,25,56 kan ha betydande men dåligt förstådda effekter på septinernas sammansättning och funktioner och därför är viktiga att så småningom införliva in vitro studier. Protokoll för rening av Borgproteiner och anillin har rapporterats54,57.
Septinreningsprotokollet som rapporteras här erbjuder ett standardiserat sätt att rena septiner i deras oligomerform med rätt subenhet stökiometri, vilket ger ett viktigt framsteg jämfört med många tidigare in vitro-studier som förlitar sig på enstaka septinunderenheter. Även om vissa septiner i specifika sammanhang kan fungera som en enda underenhet2, tyder den nuvarande litteraturen starkt på att septiner i djurceller mestadels fungerar i komplex 9,58. Därför är användningen av förformade hetero-oligomerer, såsom de som beskrivs i detta dokument och andra 10,11,18,32,35,36,37, av stor betydelse för att studera de strukturella och biofysiska egenskaperna hos septiner via in vitro rekonstitution för att dissekera deras funktioner i cellen. Dessutom är septiner självmonterande proteiner med många interaktionspartners, inklusive membranet och cytoskelettet, vilket gör dem av stort intresse för bottom-up syntetisk biologi 59,60,61 och studier av proteininducerade förändringar i membranbiofysiska egenskaper såsom krökning 42,62,63.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi tackar Cecilia de Agrela Pinto, Tomás de Garay och Katharina Häußermann för deras hjälp med massfotometriexperiment (iSCAT). Arjen Jakobi och Wiel Evers för deras hjälp med TEM; Lucia Baldauf för hennes hjälp med TIRF; Pascal Verdier-Pinard för hans råd om inhemsk elektrofores; Agata Szuba och Marjolein Vinkenoog för deras hjälp med att inrätta Drosophila septinreningsinsatser och Cell and Tissue Imaging (PICT-IBiSA), Institut Curie, medlem av den franska nationella forskningsinfrastrukturen France-BioImaging (ANR10-INBS-04). Denna forskning fick finansiering från den nederländska organisationen för vetenskaplig forskning (NWO/OCW) genom “BaSyC-Building a Synthetic Cell” Gravitation grant (024.003.019) och från Agence Nationale pour la Recherche (ANR-bidrag ANR-17-CE13-0014: “SEPTIMORF”; ANR-13-JSV8-0002-01: “SEPTIME”; och ANR-20-CE11-0014-01: “SEPTSCORT”).
Materials
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger – enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger – reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Riferimenti
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802 (2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349 (2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76 (2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203 (2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226 (2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190 (2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -. C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420 (2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315 (2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).

