הכנת פיתוח למבוגרים תסיסנית מוח רשתיות עבור הדמיה חיה
Summary
פרוטוקול זה מתאר שלוש<em> תסיסנית</em> ההכנות: 1) מוח לנתיחה למבוגרים, 2) ברשתית מבוגר לנתיחה ו 3) לפתח דיסק במוח עין לנתיחה קומפלקסים. הדגש מושם על טכניקות הכנה מיוחדת ותנאי הדמיה לחיות, למרות כל ההכנות ניתן להשתמש אימונוהיסטוכימיה רקמות קבוע.
Abstract
<em> תסיסנית</em> המוח ומערכת הראייה מנוצלים נרחב במערכות מודל ללמוד פיתוח העצבית, פונקציה וניוון. כאן אנחנו מראים three ההכנות של המוח ומערכת הראייה כי לכסות את טווח ממתחם בפיתוח עין דיסק המוח המתפתח גלמים בעין הפרט לנתיחה המוח מפני זבובים בוגרים. כל הפרוטוקולים מותאמים לתרבות חיים של ההכנות. עם זאת, אנו מציגים גם את התנאים אימונוהיסטוכימיה רקמות קבוע במקומות המתאימים. לבסוף, אנו מראים התנאים הדמיה לחיות אלה ההכנות באמצעות קונבנציונאלי ומהדהד 4D הדמיה confocal לחיות בתא זלוף. יחד, פרוטוקולים אלה מספקים בסיס הדמיה לחיות על סולמות זמן שונים, החל מבחני תאיים פונקציונלי בקנה מידה של דקות תהליכים התפתחותיים או ניווניות בהיקף של שעות רבות.
Protocol
Discussion
בדיקות ניאון משמש הדמיה
כאן אנו מתארים את נקודות החוזק ואת המגבלות של הכנת תסיסנית מערכת הראייה עבור מבחר של בדיקות ניאון משלוש מחלקות: (1) בדיקות שיתווספו הכנה רקמת חיים exogenously; (2) חלבוני ניאון כי מקודדים גנטית הן לחיות הדמיה קבוע; (3) צבעי ניאון שיתווספו רקמות קבוע אימונוהיסטוכימיה.
1. אקסוגניים בדיקות:
Lysotracker גרין DND-26 או אדום DND-99 (Invitrogen, Inc) אלה זמינים מסחרית פלורסנט קרום חדיר תרכובות להצטבר בתאים acidified חזק בתא, הבולט lysosomes, מאוחר endosomes, ואת autophagosomes. Lysotracker בריכוזים nanomolar (אנו משתמשים בדרך כלל 50 ננומטר) חודר דיסק L3 ו-P עין 20% באופן מלא פחות מדקה אחת. מאז Lysotracker ברציפות מצטבר ו מפעיל השפעה alkalizing, אנו התמונה פחות מ -5 דקות. בניגוד דיסקים העין, Lysotracker לא לחדור למוח ללא הפרעה של הרקמה. עם זאת, נזהר קריעת הקרום החיצוני מאפשר חדירה של קטרים תא כמה באונה אופטיים.
Lysosensor DND-189 (Invitrogen, Inc) בניגוד Lysotracker, Lysosensor לא לצבור בתאים acidified, אבל מפגין גדל הקרינה ב-pH חומצי. Lysosensor יש מאפיינים חדירה דומים מאוד Lysotracker. אנו משתמשים Lysosensor בריכוז של 1μM.
2. מקודד גנטית בדיקות:
עבור רבים ניסויים הדמיה לחיות, אנחנו מבטאים גנים מתוייגים עם מולקולות ניאון שונים כמו ה-GFP, TagRFP 10 או ה-pH רגיש pHluorin 11 תחת שליטה של מערכת בינארית Gal4/UAS הביטוי 12. Gal4 קווים המבטאים ב photoreceptors בפיתוח כוללים GMR-Gal4 (כל photoreceptors) 8 ו-mDelta0.5 Gal4 (פיתוח R4 ו R7) 13. מספר תת ספציפיים Gal4 נהג קווים קיימים להשתמש יזמים שונים Rhodopsin 14. בדיקות ניאון שימושי במיוחד בתחום ההדמיה לחיות הם חלבונים photoconvertible. השתמשנו בהצלחה Dendra2, חלבון monomeric ירוק ל-אדום photoconvertable 15. שים לב Dendra2 נועד להיות photoconvertible באמצעות קו ארגון 488nm לייזר. עם זאת, לא נוכל להשיג באמצעות המרת אור כחול לעין שלנו באמצעות הגדרת במצב או קונבנציונלי או סריקת תהודה confocal. לעומת זאת, המרה עם לייזר UV 405nm יעיל.
3. אימונוהיסטוכימיה:
עבור העין מבוגר קבוע, לעתים קרובות אנו לבחור phalloidin rhodamine (Invitrogen, Inc) או אנטי Chaoptin (נוגדן ספציפי photoreceptor 16) כדי להמחיש rhabdomeric מבנה (איור 1A). דרך טובה לנתח את מבנה מחסנית lamina היא לשלב אנטי chaoptin 16, סמן גליה אנטי הובנה 17, ואנטי sec6 18 (1B איור). כפי שמוצג באיור. 3, זה שילוב של נוגדנים המבדיל העיקרי presynaptic (chaoptin) ו postsynaptic (sec6) תהליכים, כמו גם גליה אפיתל (הובנה) ב lamina 19.
הרכבת לשכת זלוף
עבור הדמיה לחיות, אנחנו מעסיקים קאמרית זלוף המאפשר חילופי איטי של פתרונות מבלי להפריע הכנה רקמות. הפגנה של הרכבה קאמרית זלוף כלול וידאו ומוצגות סכמטי באיור 2. האסיפה של החדר זלוף מתוארת באיור. 2A. בגין על ידי הנחת אטם מעל הדגימה הראשונה, ולאחר מכן להמשיך עם הרכבה כפי שמוצג. מטרתו של אטם היא ליצור רווח בין הבסיס של החדר ואת המכסה, בתוך חלל שבו רקמה היא חתומה באמצעות פתרון אשר יזרמו. החלל בתוך אטם חייב לכלול את כניסת (פתרון נכנס כאן), הכנה רקמות, ולשקע שדרכו פתרון עוזב את החדר. שתי תכונות של אטם הם קריטיים: ראשית, אטם חייב להיות עבה מספיק בשביל המוח עדיין רזה מספיק כדי לאפשר הדמיה עם עדשה ברזולוציה גבוהה. עובי אטם אידיאלי תלויה הגדרת פרמטרים ספציפיים. שנית, חריץ אטם מספק בתא המאפשר בועה לעבור בלי קשר את הדגימה (איור 2B).
הדמיה על המיקרוסקופ
אנו משתמשים עדשה 63x (צמצם 1.3) טבילה גליצרין עבור החדר זלוף או עדשה 63x טבילה במים ישירות לתוך המדיום תרבות בשקופית. עדשות גליצרין לספק יותר עבודה מאשר המרחק עדשות שמן. אנו משתמשים מיקרוסקופ סורק תהודה confocal שסורקת בשיעורים הרבה יותר מהר מאשר סורק קונבנציונאלי (8000 הרץ לעומת 1400 הרץ, בהתאמה). סריקת תהודה מאפשר 3 מימדי ההקלטות לאורך זמן על מהירותאה מסגרת חליפין. בנוסף, מהירות סריקה מהירה יותר להפחית באופן משמעותי phototoxicity 6 לייזר אשר הוא החשש העיקרי עבור סריקות חוזרות ונשנות של רקמה חיה. איזון עוצמה לייזר מתח PMT (רווח) חייבת להיות מושגת על מנת למקסם את האות תוך מזעור רעש photobleaching. שיקול נוסף חשוב הוא כי כמות ההשפעה לייזר על איזור מסוים נקבעת על ידי החלטה וזום. לדוגמה, באזור הבחירה נסרק ברזולוציה באותו 256×256, זום 2x ליום 512×512, זום 1x, אך מהירות מקסימלית אפשרית הדמיה לחיות היא 4 פעמים מהר יותר ב 256×256, זום 2x. כדי להקליט את הפעילות של תאים תאיים נע במהירות, יש לנו נרשם בהצלחה עם ההגדרות הבאות: 5 frames per-z מחסנית בקצב של אחד Z-מחסנית ל 10 שניות עם מהירות סריקה של הרץ ו – 8000 בממוצע קו 2x. הפעלות הדמיה ארוך בהיקף של שעות, לעתים קרובות אנו להפחית את שיעור מסגרת אחת לכל כמה דקות ולבחור אזורים גדולים כמו הכנת סביר יותר משמרת.
תסיסנית חזותית האנטומיה מערכת
איור 3 מראה את האנטומיה של העין מבוגר תסיסנית (איור 3A), המוח הבוגר (איור 3B), ו 20% -25% מורכבים גלמי דיסק / עין המוח (איור 3 ג). איור 3A ממחיש את העין למבוגרים עם או בלי lamina ואת בתאי השומן המצורפת. במהלך דיסקציה העין מבוגרים, lamina, אשר נמצא במרכז העין השוכן בקערה שיצרו גופי התא photoreceptor (משמאל), יש להסיר מבלי לשבש את גופי התא מתחתיו (ימין). עבור לנתיחה המוח הבוגר, אחד צריך להיות מסוגל להבחין בין גופי התא photoreceptor, lamina, האונה אופטיים, המוח המרכזי, קנה הנשימה (איור 3B). Photoreceptors ואת קנה הנשימה צורך להסיר לנתיחה זה תוך השארת lamina המצורפת באונה אופטיים. כדי לסייע בזיהוי המורכב של 20-25% גלמי עין דיסק / המוח, תמונה חיה מוצג באיור 3C.
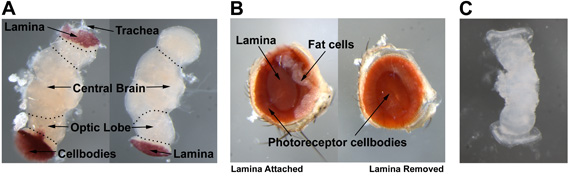
באיור 1. (א) במוח מבוגר. (ב) בוגר העין. (ג) 20% -25% מורכבים גלמי eye-disc/brain.
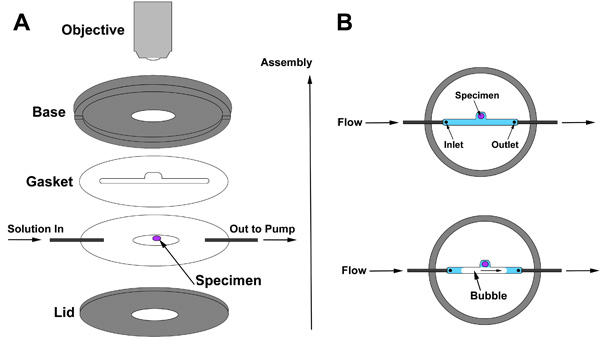
איור 2. (א) חדר זלוף הרכבה (ב) מיקום אטם יחסית הדגימה.
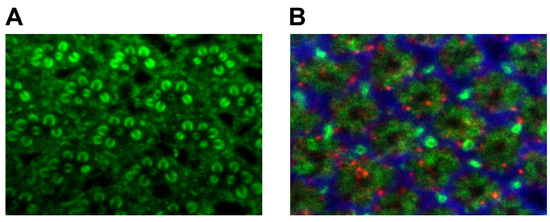
איור 3. (א) מכתים rhabdomere למבוגרים באמצעות אנטי chaoptin. (ב) lamina למבוגרים מכתים באמצעות אנטי chaoptin (ירוק, photoreceptors), אנטי הובנה (אדום, גליה), ו sec6 (כחול, interneurons).
Acknowledgements
עבודה זו נתמכה על ידי תרומות של קרן וולש (I-1657) ו-NIH (RO1EY18884). PRH הוא חוקר יוג'ין מק 'דרמוט במחקר ביו.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Sylgard 184 | Dow Corning | 103251252 | ||
| GluShield | GluStitch, Inc. | GB055QO | ||
| 20-Hydroxyecdysone | Sigma | H5142-10mg | 5mg/ml in EtOH |
Special Equipment:
- Dissection Scope: Leica Mz12.5 with digital camera
- Leica TCS SP5 Confocal Tandem-Scanner Microscope for conventional and resonant scanning live
imaging microscopy, including blue (488nm), green (561nm), orange (594nm) and far-red (633nm) lasers as well as special 63x, 1.4 glycerine and a 63x, 1.3 water immersion lenses. - Harvard Instruments Confocal Imaging Chamber RC-30 and peristaltic pump model 720
- Sutter Pipette puller P-97
- Software: Amira 5.2, Visage Imaging
References
- Stewart, B. A., Atwood, H. L., Renger, J. J., Wang, J., Wu, C. F. Improved stability of Drosophila larval neuromuscular preparations in haemolymph-like physiological solutions. J Comp Physiol A. 175 (2), 179-191 (1994).
- Walther, R. F., Pichaud, F. Immunofluorescent staining and imaging of the pupal and adult Drosophila visual system. Nat Protoc. 1, 2635-2642 (2006).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila – A Laboratory Handbook. , (2005).
- Featherstone, D. E., Chen, K., Broadie, K. Harvesting and preparing Drosophila embryos for electrophysiological recording and other procedures. J Vis Exp. , (2009).
- Borlinghaus, R. T. MRT letter: high speed scanning has the potential to increase fluorescence yield and to reduce photobleaching. Microsc Res Tech. 69, 689-692 (2006).
- Ayaz, D. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Freeman, M. Reiterative use of the EGF receptor triggers differentiation of all cell types in the Drosophila eye. Cell. 87 (4), 651-660 (1996).
- Wucherpfennig, T., Wilsch-Brauninger, M., Gonzalez-Gaitan, M. Role of Drosophila Rab5 during endosomal trafficking at the synapse and evoked neurotransmitter release. J Cell Biol. 161, 609-624 (2003).
- Merzlyak, E. M. monomeric red fluorescent protein with an extended fluorescence lifetime. Nat Methods. 4 (7), 555-557 (2007).
- Ng, M. Transmission of olfactory information between three populations of neurons in the antennal lobe of the fly. Neuron. 36 (3), 463-474 (2002).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Cooper, M. T., Bray, S. J. Frizzled regulation of Notch signalling polarizes cell fate in the Drosophila eye. Nature. 397 (6719), 526-530 (1999).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Gurskaya, N. G. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat Biotechnol. 24 (4), 461-465 (2006).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Richardt, A., Rybak, J., Stortkuhl, K. F., Meinertzhagen, I. A., Hovemann, B. T. Ebony protein in the Drosophila nervous system: optic neuropile expression in glial cells. J Comp Neurol. 452 (1), 93-102 (2002).
- Beronja, S. Essential function of Drosophila Sec6 in apical exocytosis of epithelial photoreceptor cells. J Cell Biol. 169 (4), 635-646 (2005).
- Mehta, S. Q. Mutations in Drosophila sec15 reveal a function in neuronal targeting for a subset of exocyst components. Neuron. 46 (2), 219-232 (2005).

