Geliştirilmesi ve Yetişkin hazırlanması Drosophila Brain ve Canlı Görüntüleme için Retinae
Summary
Bu protokol, üç açıklar<em> Drosophila</emGöz-beyin disk kompleksleri diseksiyonu gelişmekte> müstahzarlar: 1) yetişkin beyin diseksiyonu, 2) yetişkin retina diseksiyon ve 3). Tüm hazırlıklar sabit doku immünohistokimya için kullanılabilir olsa da vurgu, canlı görüntüleme için özel hazırlama teknikleri ve koşulları üzerine koydu.
Abstract
<em> Drosophila</em> Beyin ve görme sistemi, yaygın nöronal gelişim, işlev ve dejenerasyon incelemek için model sistemler kullanılmaktadır. Burada üç beyin hazırlıkları ve gelişmekte olan gelişmekte olan pupa göz-beyin disk kompleksi yetişkin sinekleri tek tek göz ve beyin diseksiyonu aralığı kapsayan görsel sistem göstermektedir. Tüm protokol hazırlıkları canlı kültürü için optimize edilmiştir. Ancak, biz de sabit doku immünohistokimya hallerde için şartlar mevcut. Son olarak, perfüzyon odasında konvansiyonel ve rezonans 4D konfokal canlı görüntüleme kullanarak bu hazırlıkları için canlı görüntüleme koşulları göstermektedir. Birlikte, bu protokoller, gelişimsel veya dejeneratif süreçlerin dakika ölçekte birçok saat ölçekte fonksiyonel hücre içi testleri arasında değişen farklı zaman ölçeklerinde canlı görüntüleme için bir temel sağlar.
Protocol
Discussion
Görüntüleme için kullanılır Floresan problar
Burada üç sınıfa flüoresan millerini bir seçim için Drosophila görsel sistem hazırlanması gücünü ve sınırlarını açıklar: (1) canlı bir doku hazırlanması Eksojen eklenir Problar; (2) canlı ve hem de genetik olarak kodlanmış floresan proteinleri sabit görüntüleme; immünohistokimya için sabit doku eklenir (3) floresan boyalar.
1. Eksojen problar:
Lysotracker Yeşil DND-26 veya DND-99 Kırmızı (Invitrogen, Inc.) Floresan membran geçirgen en belirgin hücre, lizozomlar güçlü asitlendirilmiş bölümlerinde biriken bileşikler, geç endosomes ve autophagosomes ticari olarak mevcuttur. Nanomolar konsantrasyonları (biz genellikle 50 nM kullanımı) Lysotracker tam bir dakikadan az bir L3 ve P +20% göz disk nüfuz eder. Lysotracker sürekli birikir ve 5 dakikadan daha az alkalize etkisi, görüntü uygular. Lysotracker göz disklerinin aksine, doku bozulması olmadan beyin nüfuz değildir. Ancak, dış zarı yırtılması dikkatli optik lob birkaç hücre çapları penetrasyon sağlar.
Lysosensor DND-189 Lysotracker için aksine (Invitrogen, Inc.) Lysosensor asitlendirilmiş bölmeleri birikir değildir, ancak sergiler asidik pH floresan arttı. Lysosensor penetrasyon Lysotracker çok benzer özelliklere sahiptir. Biz 1 mikrona kadar bir konsantrasyon Lysosensor kullanın.
2. Genetik olarak kodlanmış problar:
Birçok canlı görüntüleme deneyleri için, GFP, TagRFP 10 veya ikili Gal4/UAS ifade sistemi 12 kontrol altında pH-duyarlı pHluorin 11 gibi çeşitli flüoresan molekülleri ile etiketlenen genleri ifade eder. GMR-Gal4 (tüm fotoreseptör) 8 ve mDelta0.5 Gal4 (R4 ve R7 geliştirme) 13 gelişmekte olan fotoreseptörlerde ifade Gal4 hatları içerir . Birçok alt tipi özel Gal4 sürücü hatları kullanan farklı Rodopsin rehberleri 14 mevcuttur. Özellikle canlı görüntülemede faydalı flüoresan millerini photoconvertible proteinlerdir. Biz başarıyla Dendra2, yeşil-kırmızı bir monomerik photoconvertable protein 15 kullandık. Dendra2 488nm Argon lazer çizgisi kullanarak photoconvertible olmak için tasarlanmış olduğunu unutmayın. Ancak, set-up ya geleneksel ya da rezonans konfokal tarama modunu kullanarak görünür mavi ışık kullanarak dönüşüm elde etmek mümkün değildir. Buna karşılık, 405nm UV lazer ile dönüşüm verimlidir.
3. İmmünohistokimya:
Sabit bir yetişkin göz için, sık sık rhabdomeric yapısı (Şekil 1A) görselleştirmek için rodamin Phalloidin (Invitrogen, Inc.) Ya da anti-Chaoptin (fotoreseptör-spesifik antikor 16) seçebilirsiniz . Lamina kartuş yapısını analiz etmek için iyi bir yolu birleştirmek karşıtı chaoptin 16, anti-abanoz 17 glial marker ve anti-sec6 18 (Şekil 1B). Şekil. 3, antikorların bu kombinasyon en büyük presinaptik (chaoptin) ve postsinaptik (sec6) süreçleri gibi epitelyal lamina 19 glia (abanoz) ayırır.
Perfüzyon Odası Montajı
Canlı görüntüleme, doku hazırlanması rahatsız etmeden çözümler yavaş değişimi sağlayan bir perfüzyon odasının istihdam. Perfüzyon odamız meclisinin bir gösteri video ve şematik olarak Şekil 2'de gösterilmiştir. Perfüzyon odasının Meclis Şekil gösterilmiştir. 2A. Ilk örnek üzerinde conta koyarak başlayın ve sonra montaj ile gösterildiği gibi devam edin. Conta amacı odasının taban ve kapak, doku mühürlü ve bu yolla çözüm akacaktır içinde bir uzay arasında bir boşluk oluşturmak için. Conta içindeki boşluk giriş (çözüm burada girer), doku hazırlık ve çözüm odasına bırakır çıkış içermelidir. Conta iki özellik önemlidir: Birincisi, conta henüz yüksek çözünürlüklü lens ile görüntüleme yetecek kadar ince beyin için yeterince kalın olmalıdır. Ideal bir conta kalınlığı özgü parametreleri set-up bağlıdır. İkincisi, conta bir çentik bir kabarcık numune (Şekil 2B) ile iletişime geçmesine olanak sağlayan bir bölmesi sağlar.
Mikroskop az Görüntüleme
Biz, doğrudan bir slayt kültür ortamı içine perfüzyon odası veya 63x suya daldırma lens 63x (diyafram 1.3) gliserin daldırma lens kullanabilirsiniz. Gliserin lensler yağ lensler daha fazla çalışma mesafesi sağlar. Biz, geleneksel bir tarayıcı (8000 Hz 1400 Hz karşı, sırasıyla) çok daha hızlı fiyatla tarayan bir rezonans tarama konfokal mikroskop kullanın. Rezonans tarama hızlı zaman içinde 3 boyutlu kayıtları sağlarer çerçeve oranları. Buna ek olarak, daha hızlı tarama hızları lazer fototoksisite 6 canlı doku tekrar taramalar için önemli bir endişe önemli ölçüde azaltır. Sinyal gürültü en aza indirilmesi ve photobleaching ise en üst düzeye çıkarmak için lazer yoğunluğu ve PMT gerilimi (kazanç) bir denge sağlanmalıdır. Önemli bir diğer dikkate belirli bir bölgeye lazer etkisinin çözünürlük ve zoom miktarı tarafından belirlenir. Örneğin, tercih edilen bir bölge, 512×512, zum 1x itibariyle 256×256, Zoom 2x aynı çözünürlükte taranır, henüz maksimum olası canlı görüntüleme hızı, 256×256 Zoom 2x 4 kat daha hızlı. Aktivite, hızlı bir şekilde hücre içi bölmeleri hareket kaydetmek için, aşağıdaki ayarları başarıyla kaydettik: z-stack ortalama 5 kare tek bir oran, 10 saniyede bir tarama hızı ile 8000 Hz ve 2x hattı ortalama z-yığını. Saat ölçekte uzun görüntüleme oturumları için, genellikle birkaç dakika başına bir kare hızını azaltmak ve hazırlık kayma olasılığı daha yüksektir gibi daha geniş alanları seçin.
Drosophila Visual Sistemi Anatomisi
Şekil 3 Drosophila yetişkin göz (Şekil 3A), yetişkin beyin (Şekil 3B) ve% 20 -% 25 pupa göz disk / beyin kompleksi (Şekil 3C) anatomi gösterir. Şekil 3A ve lamina ve yağ hücrelerinin bağlı olmadan her iki yetişkin göz göstermektedir. Yetişkin göz diseksiyon sırasında, fotoreseptör hücre gövdeleri (sol) oluşturduğu bir kase içinde yuvalanmış göz merkezinde lamina (sağda) altındaki hücre organları bozmadan kaldırılır olmalıdır. Yetişkin beyin diseksiyon için bir fotoreseptör hücre gövdeleri, lamina, optik lob, merkezi beyin ve trakea (Şekil 3B) ayırt etmek gerekir. Fotoreseptör ve trakea optik lob bağlı lamina bırakarak bu diseksiyon için kaldırılması gerekir. % 20-25, pupa göz disk / beyin kompleksi belirlenmesinde yardımcı olmak için, canlı bir görüntü Şekil 3C sunulmuştur.
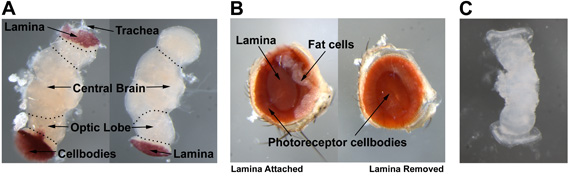
Şekil 1 (A) yetişkin beyin. (B) yetişkin göz. (C) 20% -25% pupa eye-disc/brain kompleksi.
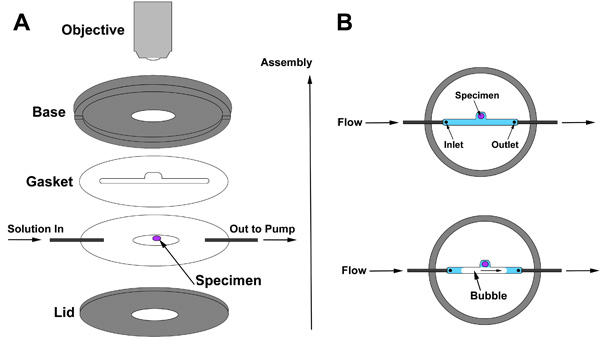
Şekil 2 (A) Perfüzyon oda montaj ve numune göre (B) conta konumlandırma.
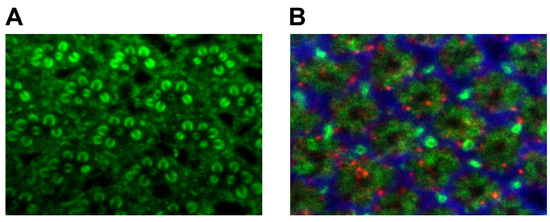
Şekil 3. (A) anti-chaoptin kullanarak Yetişkin rhabdomere boyama. Anti-chaoptin (yeşil, fotoreseptör), anti-abanoz (kırmızı, glia) ve sec6 (mavi, internöronlar) ile (B) Yetişkin lamina boyama.
Acknowledgements
Bu çalışma Welch Vakfı (I-1657) ve NIH (RO1EY18884) hibe ile desteklendi. PRH Biyomedikal Araştırma Eugene McDermott Scholar.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Sylgard 184 | Dow Corning | 103251252 | ||
| GluShield | GluStitch, Inc. | GB055QO | ||
| 20-Hydroxyecdysone | Sigma | H5142-10mg | 5mg/ml in EtOH |
Special Equipment:
- Dissection Scope: Leica Mz12.5 with digital camera
- Leica TCS SP5 Confocal Tandem-Scanner Microscope for conventional and resonant scanning live
imaging microscopy, including blue (488nm), green (561nm), orange (594nm) and far-red (633nm) lasers as well as special 63x, 1.4 glycerine and a 63x, 1.3 water immersion lenses. - Harvard Instruments Confocal Imaging Chamber RC-30 and peristaltic pump model 720
- Sutter Pipette puller P-97
- Software: Amira 5.2, Visage Imaging
References
- Stewart, B. A., Atwood, H. L., Renger, J. J., Wang, J., Wu, C. F. Improved stability of Drosophila larval neuromuscular preparations in haemolymph-like physiological solutions. J Comp Physiol A. 175 (2), 179-191 (1994).
- Walther, R. F., Pichaud, F. Immunofluorescent staining and imaging of the pupal and adult Drosophila visual system. Nat Protoc. 1, 2635-2642 (2006).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila – A Laboratory Handbook. , (2005).
- Featherstone, D. E., Chen, K., Broadie, K. Harvesting and preparing Drosophila embryos for electrophysiological recording and other procedures. J Vis Exp. , (2009).
- Borlinghaus, R. T. MRT letter: high speed scanning has the potential to increase fluorescence yield and to reduce photobleaching. Microsc Res Tech. 69, 689-692 (2006).
- Ayaz, D. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Freeman, M. Reiterative use of the EGF receptor triggers differentiation of all cell types in the Drosophila eye. Cell. 87 (4), 651-660 (1996).
- Wucherpfennig, T., Wilsch-Brauninger, M., Gonzalez-Gaitan, M. Role of Drosophila Rab5 during endosomal trafficking at the synapse and evoked neurotransmitter release. J Cell Biol. 161, 609-624 (2003).
- Merzlyak, E. M. monomeric red fluorescent protein with an extended fluorescence lifetime. Nat Methods. 4 (7), 555-557 (2007).
- Ng, M. Transmission of olfactory information between three populations of neurons in the antennal lobe of the fly. Neuron. 36 (3), 463-474 (2002).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Cooper, M. T., Bray, S. J. Frizzled regulation of Notch signalling polarizes cell fate in the Drosophila eye. Nature. 397 (6719), 526-530 (1999).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Gurskaya, N. G. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat Biotechnol. 24 (4), 461-465 (2006).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Richardt, A., Rybak, J., Stortkuhl, K. F., Meinertzhagen, I. A., Hovemann, B. T. Ebony protein in the Drosophila nervous system: optic neuropile expression in glial cells. J Comp Neurol. 452 (1), 93-102 (2002).
- Beronja, S. Essential function of Drosophila Sec6 in apical exocytosis of epithelial photoreceptor cells. J Cell Biol. 169 (4), 635-646 (2005).
- Mehta, S. Q. Mutations in Drosophila sec15 reveal a function in neuronal targeting for a subset of exocyst components. Neuron. 46 (2), 219-232 (2005).

