Подготовка Разработка и взрослых Drosophila Мозги и сетчатки для живых изображений
Summary
Этот протокол описывает три<em> Drosophila</em> Препараты: 1) вскрытие мозга взрослого человека, 2) вскрытие сетчатки взрослых и 3) разработка глаз-мозг диск комплексов рассечение. Акцент делается на специальные методы подготовки и условия для живого изображения, хотя все препараты могут быть использованы для фиксированных иммуногистохимии ткани.
Abstract
<em> Drosophila</em> Мозга и зрительной системы широко используются модельные системы для изучения нейронных развития, функции и вырождения. Здесь мы показываем три препаратов мозга и зрительной системы, которые охватывают диапазон от развивающегося глаза диска-мозг комплекса в развивающихся куколки отдельным глаз и мозг вскрытия от взрослых мух. Все протоколы, оптимизированные для живую культуру препаратов. Тем не менее, мы также представляем условия для фиксированной иммуногистохимии ткани, где это применимо. Наконец, мы покажем жить условий визуализации для этих препаратов с использованием обычных и резонансных 4D конфокальной жить изображений в перфузионной камере. Вместе взятые, эти протоколы обеспечивают основу для живого изображения в различных масштабах времени от функциональных внутриклеточных анализов по шкале минут развития или дегенеративные процессы в масштабе многих часов.
Protocol
Discussion
Флуоресцентных зондов Используется для работы с изображениями
Здесь мы опишем сильные и слабые стороны системы дрозофилы визуальной подготовки к выбору флуоресцентных зондов из трех классов: (1) Зонды, которые добавляются в живой ткани подготовки экзогенно; (2) флуоресцентные белки, которые генетически закодированы как жить и фиксированные изображения, (3) флуоресцентными красителями, которые добавляются к фиксированным ткани для иммуногистохимии.
1. Экзогенные зонды:
Lysotracker Зеленый DND-26 или Красной DND-99 (Invitrogen, Inc) Это коммерчески доступных флуоресцентных мембраны проницаемыми соединениями, которые накапливаются в сильно подкисленной отсеков в клетке, и прежде всего лизосомы, поздние эндосомы и autophagosomes. Lysotracker на наномолярных концентрации (мы обычно используем 50 нм) проникает L3 и P +20% глаза диск полностью менее чем за одну минуту. С Lysotracker непрерывно накапливается и оказывает эффект подщелачивания, мы изображение менее чем за 5 минут. В отличие от глаз диски, Lysotracker не проникает мозга без разрушения тканей. Однако тщательный разрыв наружной мембраны позволяет проникновение несколько диаметров ячейку в оптической доле.
Lysosensor DND-189 (Invitrogen, Inc) В отличие от Lysotracker, Lysosensor не накапливается в подкисленной отсеков, но экспонатов увеличилось флуоресценции при кислых рН. Lysosensor имеет проникновение характеристики, которые очень похожи на Lysotracker. Мы используем Lysosensor в концентрации 1 мкм.
2. Генетически закодированный зонды:
Для многих живых экспериментов с изображениями, мы выражаем гены с меткой различные флуоресцентные молекулы, такие как GFP, TagRFP 10 или рН-чувствительных pHluorin 11 под управлением двоичным выражением Gal4/UAS системы 12. Gal4 линий, которые выражают в развивающихся фоторецепторов включают GMR-Gal4 (все фоторецепторы) 8 и mDelta0.5-Gal4 (разработка R4 и R7) 13. Несколько подтипов конкретных Gal4-драйвер линии существуют, которые используют различные промоутеры Родопсин 14. Особенно полезными флуоресцентных зондов в живых визуализации photoconvertible белков. Мы успешно использовали Dendra2, мономерные зеленого до красного photoconvertable белка 15. Обратите внимание, что Dendra2 предназначен для использования photoconvertible 488nm Аргон лазерной линии. Однако, мы не в состоянии достичь преобразования с помощью видимого синего света с помощью нашего настройки либо в обычной, или резонансным конфокальной режиме сканирования. В отличие от преобразования с 405 нм УФ лазер эффективно.
3. Immunohistochemistry:
Для фиксированной глаз взрослого, мы часто выбирают либо родамина фаллоидином (Invitrogen, Inc) или анти-Chaoptin (фоторецептор-специфических антител 16) для визуализации rhabdomeric структуры (рис. 1А). Хороший способ для анализа структуры пластинки картриджа является сочетание анти-chaoptin 16, глиальных маркера анти-черное дерево 17, и анти-sec6 18 (рис. 1б). Как показано на рис. 3, это сочетание антител отличает крупный пресинаптические (chaoptin) и постсинаптические (sec6) процессов, а также эпителиальных глии (черное дерево) в пластинке 19.
Сборка перфузии палаты
Для живого изображения, мы используем перфузии камеры, что позволяет медленного обмена решениями, не нарушая ткани подготовки. Демонстрация перфузии сборки камеры включен в видео-и схематически показано на рисунке 2. Ассамблея перфузии камеры показан на рис. 2А. Начните с укладки прокладки по образцу, а затем продолжить сборку, как показано на рисунке. Целью прокладки для создания пространства между основанием камеры и крышки, пространство, внутри которого ткань уплотняется и через которую решение будет течь. Пространство внутри прокладка должна включать входе (раствор поступает здесь), ткани приготовительные, и выход, через который решением покидает камеру. Две особенности прокладки являются критическими: Во-первых, прокладка должна быть достаточно толстой для мозга еще достаточно тонким, чтобы изображения с высокой разрешающей способностью объектива. Идеальная толщина прокладки зависит от настройки конкретных параметров. Во-вторых, выемку прокладка обеспечивает отсек, который позволяет пузырь пройти без контакта образца (рис. 2В).
Изображений в микроскоп
Мы используем 63x (диафрагма 1.3) глицерин объектив погружения для камеры перфузии или 63x объектив погружения воды непосредственно в культуральной среде на слайде. Глицерин линзы обеспечивают более рабочее расстояние, чем нефть линз. Мы используем резонансное сканирующей конфокальной микроскопии, который сканирует на гораздо более быстрыми темпами, чем обычный сканер (8000 Гц по сравнению с 1400 Гц, соответственно). Резонансные сканирования позволяет 3-мерной записи с течением времени при быстромставки э кадра. Кроме того, более высокая скорость сканирования существенно снизить лазерной фототоксичности 6, которая представляет собой серьезную проблему для повторного сканирования живой ткани. Баланс интенсивности лазерного и ФЭУ напряжения (прибыль) должны быть достигнуты максимально сигнала при сведении к минимуму шум и фотообесцвечивания. Важно дальнейшего рассмотрения является то, что количество лазерного воздействия на данную область определяется разрешением и зумом. Например, область выбора сканируется при том же разрешении в 256х256, зум 2x по состоянию на 512×512, зум 1x, но максимально возможной скорости визуализации жить в 4 раза быстрее при 256×256, зум 2х. Для записи активности быстро движущихся внутриклеточные отсеки, мы успешно записали со следующими настройками: 5 кадров в Z-Stack в размере одного Z-Stack на 10 секунд и скорость сканирования 8000 Гц и 2x среднем линии. Для длинных сессий визуализации в масштабе часа, мы часто снижает частоту кадров до одного в течение нескольких минут и выбирать большее областях, как подготовка, скорее всего, сдвиг.
Дрозофилы Система визуального Анатомия
На рисунке 3 показана анатомия глаз дрозофилы взрослых (рис. 3А), мозга взрослого человека (рис. 3б), а 20% -25% куколки глаз диск / мозг комплекса (рис. 3в). На рис.3 показана взрослого глаза так и без пластинки и жировые клетки прилагается. Во взрослой рассечение глаза, пластинки, которая находится в центре глаза, расположенный в миску образована ячейка фоторецептора органов (слева), должна быть удалена без нарушения клеточных тел внизу (справа). Для взрослых вскрытии мозг, надо уметь отличать ячейки фоторецептора органов, пластинки, оптические доли, центральным мозгом, и трахеи (рис. 3В). Фоторецепторов и трахеи должны быть удалены для этой вскрытия, оставляя пластинки прикреплены к оптической доле. Для помощи в идентификации 20-25% куколки глаз диск / мозга сложный, живой образ представлен на рисунке 3C.
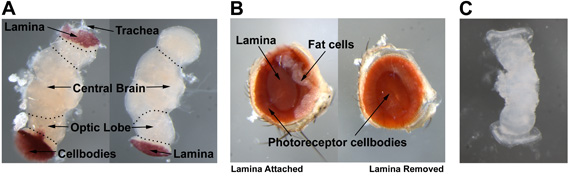
Рисунок 1. () Взрослом мозге. (В) взрослые глаза. (C) 20% -25% куколки eye-disc/brain комплекса.
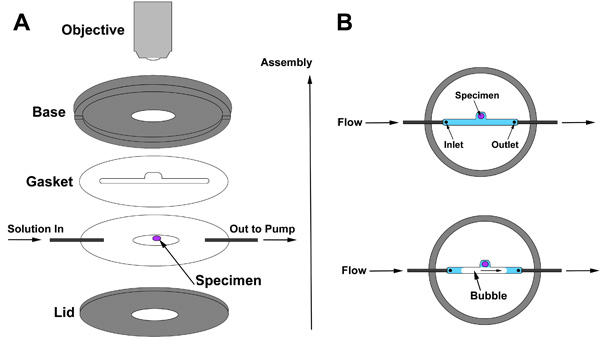
Рисунок 2. () Перфузии сборки камеры и (Б) прокладка позиционирование по отношению к образцу.
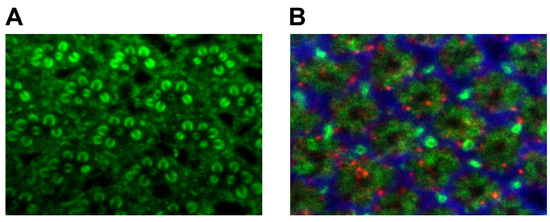
Рисунок 3. () Взрослые рабдомер окрашивания с использованием анти-chaoptin. (B) Взрослый пластинки окрашивания с использованием анти-chaoptin (зеленый, фоторецепторы), анти-черного дерева (красный, глии) и sec6 (синий, интернейронов).
Acknowledgements
Эта работа была поддержана грантами фонда Уэлч (I-1657) и NIH (RO1EY18884). PRH является выпускником школы Евгений McDermott в биомедицинских исследованиях.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Sylgard 184 | Dow Corning | 103251252 | ||
| GluShield | GluStitch, Inc. | GB055QO | ||
| 20-Hydroxyecdysone | Sigma | H5142-10mg | 5mg/ml in EtOH |
Special Equipment:
- Dissection Scope: Leica Mz12.5 with digital camera
- Leica TCS SP5 Confocal Tandem-Scanner Microscope for conventional and resonant scanning live
imaging microscopy, including blue (488nm), green (561nm), orange (594nm) and far-red (633nm) lasers as well as special 63x, 1.4 glycerine and a 63x, 1.3 water immersion lenses. - Harvard Instruments Confocal Imaging Chamber RC-30 and peristaltic pump model 720
- Sutter Pipette puller P-97
- Software: Amira 5.2, Visage Imaging
References
- Stewart, B. A., Atwood, H. L., Renger, J. J., Wang, J., Wu, C. F. Improved stability of Drosophila larval neuromuscular preparations in haemolymph-like physiological solutions. J Comp Physiol A. 175 (2), 179-191 (1994).
- Walther, R. F., Pichaud, F. Immunofluorescent staining and imaging of the pupal and adult Drosophila visual system. Nat Protoc. 1, 2635-2642 (2006).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila – A Laboratory Handbook. , (2005).
- Featherstone, D. E., Chen, K., Broadie, K. Harvesting and preparing Drosophila embryos for electrophysiological recording and other procedures. J Vis Exp. , (2009).
- Borlinghaus, R. T. MRT letter: high speed scanning has the potential to increase fluorescence yield and to reduce photobleaching. Microsc Res Tech. 69, 689-692 (2006).
- Ayaz, D. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Freeman, M. Reiterative use of the EGF receptor triggers differentiation of all cell types in the Drosophila eye. Cell. 87 (4), 651-660 (1996).
- Wucherpfennig, T., Wilsch-Brauninger, M., Gonzalez-Gaitan, M. Role of Drosophila Rab5 during endosomal trafficking at the synapse and evoked neurotransmitter release. J Cell Biol. 161, 609-624 (2003).
- Merzlyak, E. M. monomeric red fluorescent protein with an extended fluorescence lifetime. Nat Methods. 4 (7), 555-557 (2007).
- Ng, M. Transmission of olfactory information between three populations of neurons in the antennal lobe of the fly. Neuron. 36 (3), 463-474 (2002).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Cooper, M. T., Bray, S. J. Frizzled regulation of Notch signalling polarizes cell fate in the Drosophila eye. Nature. 397 (6719), 526-530 (1999).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Gurskaya, N. G. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat Biotechnol. 24 (4), 461-465 (2006).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Richardt, A., Rybak, J., Stortkuhl, K. F., Meinertzhagen, I. A., Hovemann, B. T. Ebony protein in the Drosophila nervous system: optic neuropile expression in glial cells. J Comp Neurol. 452 (1), 93-102 (2002).
- Beronja, S. Essential function of Drosophila Sec6 in apical exocytosis of epithelial photoreceptor cells. J Cell Biol. 169 (4), 635-646 (2005).
- Mehta, S. Q. Mutations in Drosophila sec15 reveal a function in neuronal targeting for a subset of exocyst components. Neuron. 46 (2), 219-232 (2005).

