زراعة والكهربية من الخلايا على رقائق التصحيح، المشبك NRCC
Summary
نظهر كيف مستو التصحيح، المشبك رقائق ملفقة في المجلس الوطني للبحوث في كندا يتم تعقيم، تستعد، محملة المتوسطة، مطلي مع الخلايا، ويستخدم لتسجيلات الكهربية.
Abstract
نظرا لحساسيتها الفائقة والقدرة على رصد ومراقبة الخلايا الفردية على مستوى القنوات الأيونية، والتصحيح، تحامل هو معيار الذهب من الكهربية المطبقة على نماذج من الأمراض وشاشات الأدوية على حد سواء 1. الأسلوب ينطوي تقليديا الاتصال بلطف زنزانة مع ماصة الزجاج يشغلها حل الفسيولوجية من أجل عزل قطعة من الغشاء تحت ذروته 2. إلكترود إدراجها في ماصة يلتقط ايون قناة نشاط داخل غشاء أو التصحيح، عندما تمزق، لخلية كاملة. في العقد الماضي، تم اقتراح التصحيح، المشبك رقائق كبديل 3 و 4: فيلم وعلقت يفصل بين المتوسطة الفسيولوجية من ثقافة المتوسط، وفتحة microfabricated في الفيلم محل ذروة ماصة. وقد تم إدماج التصحيح، المشبك رقائق في النظم الآلية وتسويقها للالفرز الفائق الإنتاجية 5. إلى incrتخفيف من الناتج، وأنها تشمل تسليم fluidic من الخلايا من التعليق، وتحديد المواقع الخاصة بهم على فتحة بواسطة الشفط، والروتين الآلي للكشف عن خلية إلى تحقيق الأختام والدخول في وضع خلية كاملة. وأفادت ونحن على تصنيع شريحة التصحيح، المشبك السيليكون مع مقاومة محسنة وشكل فتحة تسمح بتسجيل عالي الجودة من إمكانات العمل في الخلايا العصبية حلزون مثقف 6؛ مؤخرا، ونحن وذكرت أيضا التقدم نحو استجواب الخلايا العصبية في الثدييات 7. هي ملفقة لدينا التصحيح، المشبك رقائق في المركز الكندي تلفيق الضوئيات 8، مسبك التجارية، وتتوفر في سلسلة كبيرة. نحن حريصون على الدخول في تعاون مع electrophysiologists للتحقق من صحة استخدام التكنولوجيا NRCC في نماذج مختلفة. وتستخدم رقائق وفقا للمخطط العام وتتمثل في الشكل رقم 1: لشرائح السليكون هو في الجزء السفلي من قارورة ثقافة زجاجي والجزء الخلفي من فتحة متصلة chann الجوفيةشرم مزودة أنابيب على طرفي الصفقة. يتم استزراع الخلايا في قنينة ويتم رصد الخلية على رأس لجنة التحقيق من قبل القطب القياس المدرجة في 2 channel.The خارج الموانئ fluidic تسهيل تبادل حل مع الحد الأدنى من إزعاج للخلية، وهذه هي ميزة مقارنة مع ماصات زجاجية للداخل الخلايا نضح.
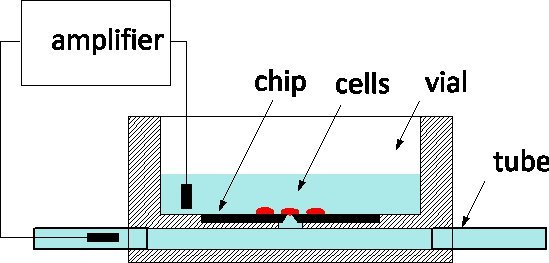
الشكل 1. مبدأ القياس باستخدام NRCC التصحيح، المشبك رقاقة
نحن هنا من التفصيل البروتوكولات لتعقيم ورئيس والرقائق، تحميلها مع لوحة، والمتوسطة منها مع الخلايا، واستخدم أخيرا لهم للتسجيلات الكهربية.
Protocol
Discussion
NRCC لاستجواب رقاقة التصحيح، المشبك برنامجه هو أداة قوية لارتفاع المقايسات محتوى معلومات الأدوية والتحقيق في نماذج في المختبر من المرض. مزاياها مقارنة الماصات الزجاجية هي مقاومة وصول المنخفض، والتي هي ميزة للتحقيق في الخلايا الكبيرة، وعلى الرغم من سعة أكبر إلى حد ما سيؤدي في ديناميات مماثلة لأصغر الخلايا. وقد تم الخلية من تلقاء أنفسهم إلى أختام الفتحة التي تم الحصول عليها بشكل روتيني، وقد لوحظ كل دخول الخلية لتكون 14 عفوية. وهناك فرق واضح بين شرائح وطريقة ماصة الزجاج هو حقيقة أن لجنة التحقيق هو جزء من خلية طبق والثقافة، وإذا لم يقدم يدويا في اتصال مع غشاء الخلية. زراعة الخلايا، وربما جزء من شبكات وظيفية، والنتائج في المزيد من النماذج ذات الصلة من الناحية البيولوجية كنماذج المرض، وآلية مختلفة لتأمين خلية عالية للتحقيق في الأختام 16. لكن، على النقيض من ذلك مع تعليق خلية، طموح المدفعتي أن تستخدم لوضع خلية في التحقيق. الخلايا العصبية الحلزون، والخلايا الكبيرة الأخرى، قابلة للتحديد المواقع دليل على رأس لجنة التحقيق. لأصغر الخلايا التي تتطلب فترات زمنية أطول والثقافة، ونحن قد ينفي الحاجة إلى أي تلاعب والحفاظ على وجود احتمال كبير للحصول على ختم من قبل البروتينية التصاق الزخرفة على الجزء العلوي من تحقيقات لوضع الخلايا على الجزء العلوي من تحقيقات، وأظهر وضع الخلايا على مسبار 17،18.
NRCC أيضا بوضع بوليميد ميكروفلويديك التصحيح، المشبك رقاقة 19 مع السعة المماثلة لتلك التي ماصة الزجاج. الهدف النهائي من هذا المشروع هو عبارة عن تحقيقات متعددة التصحيح، المشبك رقاقة الذي يسمح للرصد في وقت واحد لنشاط الخلايا العصبية الكهربية من عدة تعمل في سلوك الشبكة على قرار من القنوات الأيونية فرد 14. هذا الأسلوب هو أسلوب ارتفاع القرار مكملا للمصفوفات متعددة القطب-20.
Disclosures
The authors have nothing to disclose.
Acknowledgements
الكتاب يرغبون في الاعتراف اليكسي بوغدانوف لتصنيع رقائق التصحيح، المشبك في CPFC، وهوى تران، تشاو بينغ وشيو ماثيو للحصول على المساعدة مع الجمعية. وأيد Naweed سيد من قبل المعهد الكندي للمنح الصحة (CIHR) بحوث. كولين لوقا هو المستفيد من NSERC وألبرتا مؤسسة التراث عن منحة دراسية الطبية (AHFMR) البحوث.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P., Windhorst, U., Johansson, H. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. , (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -. L., Yobas, L., Ong, W. -. Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. o. m. a. s., Monette, T., Py, R., A, C. K. r. a. n. t. i. s., Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. . Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , (2006).

