Coltura ed Elettrofisiologia di Celle NRCC patch-clamp Chips
Summary
Mostriamo come planare patch-clamp chip fabbricato presso il National Research Council of Canada sono sterilizzati, innescato, caricato con il mezzo, placcato con le cellule, ed utilizzato per le registrazioni elettrofisiologiche.
Abstract
Grazie alla sua squisita sensibilità e la capacità di monitorare e controllare le singole cellule a livello dei canali ionici, patch-bloccaggio è il gold standard di elettrofisiologia applicata a modelli di malattia e gli schermi farmaceutiche egualmente 1. Il metodo comporta tradizionalmente delicatamente a contatto una cellula con una pipetta di vetro riempita da una soluzione fisiologica per isolare una zona della membrana sotto il suo apice 2. Un elettrodo inserito nella pipetta cattura canale ionico attività all'interno del cerotto membrana o, quando rottura, per tutta la cella. Nell'ultimo decennio, patch-clamp chip sono stati proposti come alternativa 3, 4: una pellicola sospesa separa il mezzo fisiologica dal mezzo di coltura, e un'apertura microfabbricata nel film sostituisce l'apice della pipetta. Patch-clamp chip sono stati integrati in sistemi automatizzati e commercializzato per la high-throughput screening 5. Per incrfacilità velocità, esse comprendono la fornitura fluidico di celle da sospensione, il loro posizionamento sul diaframma di aspirazione, e procedure automatizzate per rilevare cellula-sonda guarnizioni ed entrare nella modalità a cellula intera. Abbiamo riportato la realizzazione di una patch-clamp chip di silicio con impedenza ottimizzati e la forma dell'orifizio che permette l'alta qualità di registrazione dei potenziali d'azione nei neuroni di lumaca colture 6; di recente, abbiamo segnalato i progressi compiuti interrogando i neuroni dei mammiferi 7. I nostri patch-clamp chip sono realizzati presso la Canadian Photonics Fabrication Centro 8, una fonderia commerciale, e sono disponibili in grande serie. Siamo desiderosi di impegnarsi in collaborazioni con elettrofisiologi per convalidare l'uso della tecnologia NRCC in diversi modelli. I chip vengono usati secondo lo schema generale rappresentato nella figura 1: il chip di silicio è sul fondo di una fiala cultura plexiglas e la parte posteriore del diaframma è collegato ad un sotterraneo Channel dotato di tubi alle estremità del pacchetto. Le cellule vengono coltivate nella fiala e la cella sulla parte superiore della sonda è controllata da un elettrodo di misura inserito nel channel.The due porte fuori fluidici facilitare lo scambio di soluzione con il minimo disturbo alla cella, questo è un vantaggio rispetto alle pipette vetro per intracellulare perfusione.
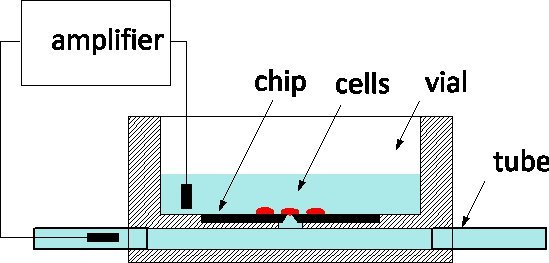
Figura 1. Principio di misurazione utilizzando la NRCC patch-clamp truciolo
Noi dettaglio qui i protocolli di sterilizzare e innescare i circuiti integrati, caricarli con il mezzo, li piatto con le cellule, e, infine, li usano per le registrazioni elettrofisiologiche.
Protocol
Discussion
NRCC di patch-clamp piattaforma interrogatorio chip è uno strumento potenzialmente efficace per le prove ad alto contenuto di informazione farmaceutica e di indagare in modelli in vitro di malattia. I suoi vantaggi rispetto alle pipette di vetro sono una resistenza di accesso bassa, che è un vantaggio per sondare le cellule grandi, e nonostante una capacità leggermente maggiore comporta dinamica comparabili per celle più piccole. Cellula spontanea alle guarnizioni di apertura sono stati regolarmente ottenuti, e l'entrata a cellula intera è stato osservato che il 14 spontanea. Una chiara differenza tra i chip e il metodo pipetta di vetro è il fatto che la sonda è parte della piastra di coltura cellulare e non è manualmente portato in contatto con la membrana cellulare. Coltura di cellule, eventualmente parte di reti funzionali, risultati in modelli più biologicamente rilevanti, come modelli di malattia, e un diverso meccanismo per assicurare celle ad alta tenuta per sondare 16. Tuttavia, in contrasto con sospensioni cellulari, aspirazione cannot essere utilizzato per posizionare una cella sulla sonda. Neuroni Snail, come altre grandi cellule, sono suscettibili di posizionamento manuale sulla parte superiore della sonda. Per il posizionamento piccole cellule che richiedono lunghi tempi di coltura, si è ovviato la necessità di manipolazione e di mantenere una elevata probabilità di ottenere un sigillo di polipeptidi adesione patterning sopra le sonde per posizionare le cellule sopra delle sonde, e ha dimostrato di celle sul Sonda 17,18.
NRCC sta sviluppando una poliimmide microfluidica patch-clamp circuito 19 con una capacità paragonabile a quella del vetro pipetta. L'obiettivo finale di tale progetto è a più sonde patch-clamp chip che consente il monitoraggio simultaneo dell'attività elettrofisiologica dei neuroni più impegnate nel comportamento della rete alla risoluzione dei canali ionici singoli 14. Questo metodo è un metodo ad alta risoluzione complementare a multi-elettrodo array 20.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare Alexei Bogdanov per la realizzazione di patch-clamp chip al CPFC e Hue Tran, Zhao Ping e Matthew Shiu per l'assistenza al montaggio. Naweed Syed è stata sostenuta da una Canadian Institute of Health Research (CIHR) sovvenzione. Collin Luk è il destinatario di NSERC e Alberta Heritage Foundation for Medical Research (AHFMR) borse di studio.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P., Windhorst, U., Johansson, H. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. , (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -. L., Yobas, L., Ong, W. -. Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. o. m. a. s., Monette, T., Py, R., A, C. K. r. a. n. t. i. s., Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. . Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , (2006).

