El cultivo y la electrofisiología de las células en NRCC de patch-clamp chips
Summary
Mostramos cómo plana patch-clamp fichas fabricadas en el Consejo de Investigación Nacional de Canadá se esterilizan, preparado, cargado con el medio, recubierto de células, y se utiliza para los registros electrofisiológicos.
Abstract
Debido a su exquisita sensibilidad y la capacidad de monitorear y controlar las células individuales en el nivel de los canales iónicos, de patch-clamp es el estándar de oro de la electrofisiología se aplica a modelos de enfermedad y las pantallas de farmacéuticos por igual 1. El método implica tradicionalmente suavemente en contacto una célula con una pipeta de vidrio lleno de una solución fisiológica con el fin de aislar un parche de la membrana bajo su vértice 2. Un electrodo insertado en la pipeta captura de iones canal actividad dentro del parche o membrana, cuando se rompió, por toda la celda. En la última década, patch-clamp virutas se han propuesto como una alternativa 3, 4: una película suspendido separa el medio fisiológico del medio de cultivo, y una abertura en la película microfabricated reemplaza el ápice de la pipeta. Patch-clamp fichas se han integrado en los sistemas automatizados y comercializado para el cribado de alto rendimiento 5. Para incrfacilitar el rendimiento, que incluyen la entrega de fluidos de las células de la suspensión, su posicionamiento en la apertura por medio de succión, y las rutinas automatizadas para la detección de la célula a la sonda juntas y entrar en el modo de célula entera. Nos han informado sobre la fabricación de silicio de un chip de patch-clamp con una impedancia optimizada y forma del orificio que permite la grabación de alta calidad de los potenciales de acción en las neuronas cultivadas de 6 caracoles, recientemente, también han informado de los progresos hacia el interrogatorio neuronas de mamíferos 7. Nuestros patch-clamp chips son fabricados en el Centro Canadiense de Fabricación Fotónica 8, un comercial de la fundición, y están disponibles en grandes series. Estamos ansiosos de participar en la colaboración con los electrofisiólogos para validar el uso de la tecnología NRCC en diferentes modelos. Los chips se utilizan de acuerdo con el esquema general representada en la figura 1: el chip de silicio está en el fondo de un frasco de cultivo de plexiglás y la parte posterior de la abertura está conectado a un subterráneo ChannEl provista de tubos en cada extremo del paquete. Las células se cultivaron en el vial y la célula en la parte superior de la sonda se controla mediante un electrodo de medición insertado en el channel.The dos fuera de los puertos fluídicos facilitar el intercambio de solución con una perturbación mínima a la celda, lo cual es una ventaja en comparación con pipetas de vidrio para intracelular perfusión.
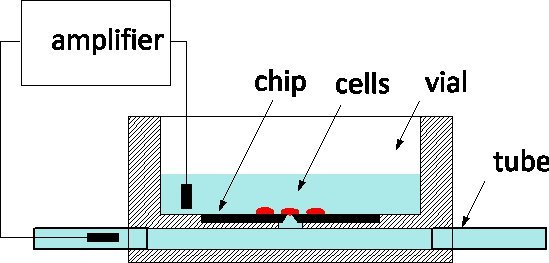
Figura 1. Principio de medición usando el NRCC parche-abrazadera de chip
Detallamos aquí los protocolos de esterilización y preparar las patatas fritas, cargarlos con el medio, a la placa con las células y, finalmente, los utilizan para registros electrofisiológicos.
Protocol
Discussion
Patch-clamp NRCC la plataforma de la interrogación chip es una herramienta potencialmente poderosa para la alta ensayos de contenido de información farmacéutica y para investigar en modelos in vitro de la enfermedad. Sus ventajas en comparación con pipetas de vidrio son una resistencia acceso bajo, lo cual es una ventaja para sondear células grandes, ya pesar de una capacitancia algo mayor resultará en la dinámica comparables para células más pequeñas. Celular espontánea a los sellos de apertura se han obtenido rutinariamente, y la entrada de células enteras se ha observado que 14 espontánea. Una diferencia clara entre los chips y el método de pipeta de vidrio es el hecho de que la sonda es parte de la placa de cultivo de células y no es manualmente pone en contacto con la membrana celular. El cultivo de células, posiblemente parte de las redes funcionales, los resultados de los modelos más relevantes biológicamente como modelos de enfermedades, y un mecanismo diferente para asegurar la celda de alta para probar los sellos 16. Sin embargo, en contraste con las suspensiones de células, la aspiración Cannot se utiliza para posicionar una celda de la sonda. Neuronas del caracol, como otras células grandes, son susceptibles de posicionamiento manual en la parte superior de la sonda. Para células más pequeñas que requieren largos tiempos de cultivo, hemos obviado la necesidad de cualquier manipulación y mantener una alta probabilidad de obtener un sello por polipéptidos de adhesión de modelado en la parte superior de las sondas para colocar las células en la parte superior de las sondas, y demostró la colocación de las células en el sonda de 17,18.
NRCC también está desarrollando una poliimida microfluidos parche-abrazadera chip de 19 con una capacitancia comparable a la del vidrio pipeta. El objetivo final de que es un proyecto múltiples sondas-parche-abrazadera chip que permite el control simultáneo de la actividad electrofisiológica de las neuronas que participan en varias comportamiento de la red en la resolución de los canales iónicos individuales 14. Este método es un método de alta resolución complementaria a las matrices de electrodos múltiples 20.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores desean agradecer Alexei Bogdanov para la fabricación de chips de patch-clamp en el CPFC y Hue Tran, Zhao Ping y Shiu Mateo para obtener ayuda con el montaje. Naweed Syed fue apoyada por un Instituto Canadiense de Investigación en Salud (CIHR) subvención. Collin Luk es el receptor de NSERC y Alberta Heritage Foundation for Medical Research (AHFMR) becas de.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P., Windhorst, U., Johansson, H. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. , (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -. L., Yobas, L., Ong, W. -. Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. o. m. a. s., Monette, T., Py, R., A, C. K. r. a. n. t. i. s., Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. . Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , (2006).

