Kweken en Elektrofysiologie van cellen op NRCC Patch-clamp Chips
Summary
We laten zien hoe vlakke patch-clamp chips gefabriceerd op de National Research Council of Canada worden gesteriliseerd, gegrond, geladen met medium, bedekt met cellen, en gebruikt voor elektrofysiologische opnamen.
Abstract
Door zijn uitstekende gevoeligheid en het vermogen om te bewaken en controleren van individuele cellen op het niveau van ionkanalen, patch-spannen is de gouden standaard van elektrofysiologie toegepast op de ziekte-modellen en farmaceutische schermen zowel 1. De werkwijze omvat gewoonlijk zacht contact brengen van een cel met een glazen pipet opgevuld met een fysiologische oplossing om een stuk het membraan isoleren onder de top 2. Een elektrode geplaatst in de pipet legt ionkanaal activiteit in het membraan pleister of wanneer gescheurd voor de gehele cel. In het laatste decennium patch-clamp chips zijn voorgesteld als alternatief 3, 4: een onderbroken film scheidt de fysiologische medium uit het kweekmedium en een opening in de film microfabricated vervangt de top van de pipet. Patch-clamp chips zijn geïntegreerd in geautomatiseerde systemen en op de markt voor high-throughput screening 5. Om incrgemakkelijk doorvoer zij omvatten de vloeibare levering van cellen van suspensie, de positie van het diafragma door afzuigen en geautomatiseerde routines cel-probe afdichtingen detecteren en sluiten gehele cel mode. We hebben gerapporteerd over de fabricage van een silicium patch-clamp chip met geoptimaliseerde impedantie en opening vorm die de hoge kwaliteit opname van actiepotentialen in gekweekte neuronen slak 6 toelaat, onlangs hebben we ook gemeld vooruitgang op weg naar het ondervragen van zoogdieren neuronen 7. Onze patch-clamp chips worden vervaardigd op de Canadese Photonics Fabrication Center 8, een commerciële gieterij, en zijn verkrijgbaar in grote series. We staan te popelen om deel te nemen in samenwerking met elektrofysiologen het gebruik van de NRCC technologie in verschillende modellen te valideren. De chips worden gebruikt volgens de algemene regeling in figuur 1 weergegeven: de chip is aan de bodem van een plexiglas cultuur flacon en de achterzijde van de opening is verbonden met een ondergrondse-zendersel uitgerust met buizen aan weerszijden van het pakket. Cellen gekweekt in de flacon de cel van de sonde wordt bewaakt door een meetelectrode opgenomen in de twee buitenste channel.The vloeibare poorten oplossing, gemakkelijker met minimale verstoring van de cel is een voordeel ten opzichte van glas pipetten voor intracellulaire perfusie.
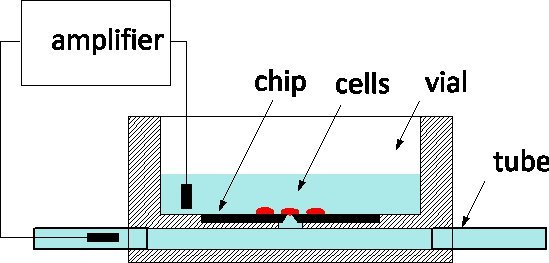
Figuur 1. Principe van de meting met behulp van de NRCC patch-clamp-chip
We detail hier de protocollen te steriliseren en ontluchten van de chips, ze laden met medium, plaat ze met cellen, en uiteindelijk deze te gebruiken voor elektrofysiologische opnamen.
Protocol
Discussion
NRCC's patch-clamp chip ondervraging platform is een potentieel krachtig hulpmiddel voor hoge informatie-inhoud farmaceutische testen en te onderzoeken in vitro modellen van de ziekte. De voordelen ten opzichte van glas pipetten een laag toegang weerstand, die een voordeel grote cellen probe, en ondanks een iets grotere capaciteit resulteert in dynamiek vergelijkbare kleinere cellen. Spontane cel om diafragma zegels zijn routinematig verkregen, en hele celinvoer is waargenomen dat spontane 14 te zijn. Een duidelijk verschil tussen chips en het glas pipet methode is dat de probe deel van de cel kweekschaal en niet handmatig in contact gebracht met de celmembraan. Het kweken van cellen, eventueel van functionele netwerken, resulteert in biologisch relevante modellen ziektemodellen en een ander mechanisme voor het vastzetten hoge cel sonde afdichtingen 16. Echter, in tegenstelling tot celsuspensies, aspiratie cannot worden gebruikt om een cel op de sonde positioneren. Slak neuronen, zoals andere grote cellen, vatbaar zijn voor manuele positionering van de sonde. Voor kleinere cellen die een langere tijd cultuur hebben wij overbodig maakte een manipulatie en houdt een grote kans op het verkrijgen van een afdichting met patronen hechting Polypeptiden bovenop de probes cellen bovenop de probes en aangetoond plaatsing van cellen op de probe 17,18.
NRCC wordt ook aan een polyimide microfluïdisch patch-clamp chip 19 met een capaciteit vergelijkbaar met die van glas pipet. Het uiteindelijke doel van dat project is een multiple-probes patch-clamp-chip die het mogelijk maakt de gelijktijdige controle van de elektrofysiologische activiteit van een aantal neuronen betrokken zijn in het netwerk van gedrag bij de resolutie van de individuele ionkanalen 14. Deze methode is een hoge resolutie complementaire methode multi-elektrode arrays 20.
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs willen Alexei Bogdanov te erkennen voor de fabricage van patch-clamp chips op de CPFC, en Hue Tran, Ping Zhao en Matthew Shiu helpen bij de montage. Naweed Syed werd ondersteund door een Canadese Institute of Health Research (CIHR) subsidie. Collin Luk is de ontvanger van NSERC en Alberta Heritage Foundation for Medical Research (AHFMR) studiebeurzen.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P., Windhorst, U., Johansson, H. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. , (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -. L., Yobas, L., Ong, W. -. Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. o. m. a. s., Monette, T., Py, R., A, C. K. r. a. n. t. i. s., Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. . Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , (2006).

