Beurteilung der neuromuskulären Funktion Mit Perkutane elektrische Nervenstimulation
Summary
We present a protocol to assess changes in neuromuscular function. Percutaneous electrical nerve stimulation is a non-invasive method that evokes muscular responses. Electrophysiological and mechanical properties of these responses permit the evaluation of neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels).
Abstract
Percutaneous electrical nerve stimulation is a non-invasive method commonly used to evaluate neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels). The present protocol describes how this method can be used to stimulate the posterior tibial nerve that activates plantar flexor muscles. Percutaneous electrical nerve stimulation consists of inducing an electrical stimulus to a motor nerve to evoke a muscular response. Direct (M-wave) and/or indirect (H-reflex) electrophysiological responses can be recorded at rest using surface electromyography. Mechanical (twitch torque) responses can be quantified with a force/torque ergometer. M-wave and twitch torque reflect neuromuscular transmission and excitation-contraction coupling, whereas H-reflex provides an index of spinal excitability. EMG activity and mechanical (superimposed twitch) responses can also be recorded during maximal voluntary contractions to evaluate voluntary activation level. Percutaneous nerve stimulation provides an assessment of neuromuscular function in humans, and is highly beneficial especially for studies evaluating neuromuscular plasticity following acute (fatigue) or chronic (training/detraining) exercise.
Introduction
Perkutane elektrische Nervenstimulation wird weithin verwendet, um die neuromuskuläre Funktion 1 zu bewerten. Das Grundprinzip besteht aus Induktion einer elektrischen Stimulus zu einer peripheren motorischen Nerven, um eine Muskelkontraktion hervorzurufen. Mechanische (Drehmomentmessung) und elektrophysiologische (elektromyographische Aktivität) Reaktionen werden gleichzeitig aufgezeichnet. Drehmoment an der betrachteten gemeinsame aufgezeichnet ist, wird unter Verwendung eines Ergometers bewertet. Elektromyographischen (EMG) Signal aufgezeichnet unter Verwendung von Oberflächenelektroden wurde gezeigt, dass die Aktivität des Muskels 2 stellen. Diese nicht-invasive Methode ist nicht schmerzhaft und leichter als intramuskuläre Aufnahmen realisiert. Sowohl monopolare als auch bipolare Elektroden verwendet werden. Die monopolaren Elektrodenkonfiguration wurde gezeigt empfindlicher auf Änderungen der Muskeltätigkeit 3, die kleine Muskeln nützlich sein kann ist. Jedoch haben bipolare Elektroden gezeigt wirksamer bei der Verbesserung des Signal-Rausch-r zu seintio 4 und werden am häufigsten als ein Verfahren zum Aufzeichnen und zur Quantifizierung Motoreinheit Aktivität verwendet. Die nachfolgend beschriebene Methodik wird auf bipolare Aufnahmen konzentrieren. EMG-Aktivität ein Indikator für die Wirksamkeit und die Integrität des neuromuskulären Systems. Die Verwendung von perkutanen Nervenstimulation bietet weitere Einblicke in die neuromuskuläre Funktion, dh Änderungen an Muskel-, Wirbelsäulen oder supra spinaler Ebene (Abbildung 1).
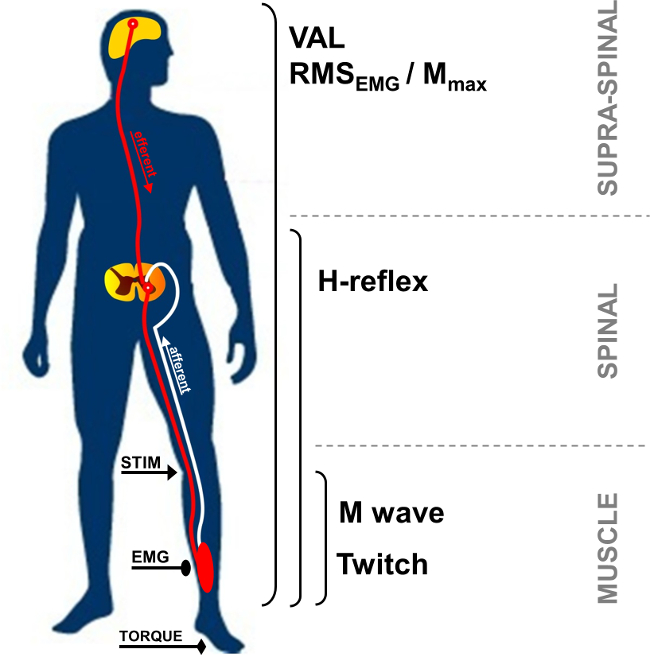
Abb. 1: Übersicht über die neuromuskuläre Messungen STIM: Nervenstimulation. EMG: Elektromyographie. VAL: Freiwillige Aktivierungsniveau. RMS: Root Mean Square. M max: Maximal M-Wellen-Amplitude.
Im Ruhezustand wird die Verbindung Muskelaktionspotential, auch als M-Welle, ist die kurze Latenzzeiten Reaktion nach Reizartefakt beobachtet und stellt erregbaren Muskelmasse durch die direkte activ ation von Motoraxonen die zur Muskel (Abbildung 2, Nummer 3). M-Wellenamplitude steigt mit der Intensität bis zum Erreichen einer Hochebene von seinem Maximalwert. Diese Antwort, die so genannte M max, stellt die Synchron Summierung aller unter den Oberflächen-EMG-Elektroden 5 aufgezeichneten Motoreinheiten und / oder Muskelfaser Aktionspotentiale. Die Entwicklung der Spitze-zu-Spitze-Amplitude oder Wellenbereich verwendet wird, um Änderungen der neuromuskulären Transmission 6 identifizieren. Veränderungen der mechanischen Reaktionen mit dem M-Welle, dh Spitzen Zucken Drehmoment / Kraft, verbunden sind, können aufgrund von Veränderungen im Muskel Erregbarkeit und / oder innerhalb der Muskelfasern 7 sein. Die Assoziation von M max Amplitude und Spitzen Zucken Drehmomentamplitude (Pt / M-Verhältnis) liefert einen Index von elektromechanischen Wirkungsgrad des Muskel 8, dh mechanische Reaktion für eine gegebene elektrische Motorbefehl.
52974 / 52974fig2.jpg "/>
Abb. 2: Motor und reflexive Pfade durch Nervenstimulation aktiviert elektrische Stimulation eines gemischten (Motor / sensorische) Nerven (STIM) induziert eine Depolarisation der beiden Motor Axon und Ia afferenten Brand. Depolarisation Ia Afferenzen Richtung des Rückenmarks aktiviert ein alpha Motoneuronen, die wiederum ruft eine H-Reflex-Reaktion (Bahn 1 + 2 + 3). In Abhängigkeit von der Reizstärke, Motor Axon Depolarisation evoziert eine direkte muskuläre Antwort: M-Welle (Weg 3). Bei maximaler M-Wellenintensität wird ein antidrome Strom auch generiert (3 ') und kollidiert mit Reflex volley (2). Diese Kollision teilweise oder vollständig bricht den H-Reflex auf.
Der H-Reflex ist eine elektrophysiologische Reaktion verwendet, um Veränderungen in der Ia-α Motoneuron Synapse 9 beurteilen. Dieser Parameter kann im Ruhezustand oder während der freiwilligen Kontraktionen bewertet werden. H-Reflex stellt eine Variante des Dehnungsreflex (Abbildung 2, number 1-3). Der H-Reflex aktiviert Motoreinheiten monosynaptisch von Ia afferente Bahnen 10,11 rekrutiert, und kann eine periphere und zentrale Einflüsse 12 unterzogen werden. Das Verfahren erinnert an einen H-Reflex ist bekannt, dass eine hohe intraindividuelle Zuverlässigkeit Rücken Erregbarkeit in Ruhe 13,14 und während isometrische Kontraktionen 15 zu beurteilen haben.
Während einer willkürlichen Kontraktion, kann der Betrag der freiwilligen neuronalen Antrieb mit der Amplitude des EMG-Signals beurteilt werden, mit Hilfe der Root Mean Square Allgemeinen quantifiziert (RMS). RMS-EMG wird häufig verwendet, ein Mittel zur Quantifizierung der Erregung des Motorsystems während einer willkürlichen Kontraktion (Abbildung 1). Wegen der intra- und interindividuelle Variabilität 16 hat RMS EMG zur Verwendung der EMG während eines muskelspezifischen maximalen willkürlichen Kontraktion (RMS EMGmax) aufgezeichnet normalisiert werden. Darüber hinaus, weil Änderungen in EMG-Signal be aufgrund von Veränderungen am peripheren Ebene, die Normalisierung unter Verwendung eines peripheren Parameter, wie beispielsweise M-Welle erforderlich ist, um nur die zentrale Komponente des EMG-Signals zu beurteilen. Dies kann durch Dividieren der RMS-EMG durch die maximale Amplitude oder der Effektivwert Mmax der M-Welle durchgeführt werden. Normalisierung mit RMS Mmax (dh RMS EMG / RMS Mmax) ist die bevorzugte Methode, da sie berücksichtigt die mögliche Änderung der M-Wellendauer 17.
Motor Befehle können auch durch die Berechnung der freiwilligen Aktivierungsniveau (VAL) ausgewertet werden. Diese Methode verwendet das Zucken Interpolationstechnik 18 durch Überlagerung einer elektrischen Stimulation an M max Intensität während einer maximalen willkürlichen Kontraktion. Das zusätzliche Drehmoment durch die Stimulierung der Nerven hervorgerufen wird, um eine gleich Nervenstimulation in entspannter potenziert Muskel 19 erzeugte Kontrollzuckungsstärke verglichen. Um maximale VAL, das ursprüngliche Zucken interpo bewertenvon Merton 18 beschrieben lation Technik beinhaltet einen einzelnen Stimulus über einen willkürlichen Kontraktion interpoliert. Kürzlich wurde die Verwendung von paarweisen Stimulation immer beliebter geworden, da die hervorgerufenen Drehmoment Inkrementen größer sind, leichter erkannt und weniger variabel gegenüber dem Einzelstimulationsantworten 20. VAL liefert einen Index der Leistungsfähigkeit des Zentralnervensystems bis maximal aktivieren die arbeitenden Muskeln 21. Derzeit VAL ausgewertet mit dem Zucken Interpolationstechnik ist das wertvollste Methode zur Beurteilung der Höhe der Muskelaktivierung 22. Darüber hinaus ist das maximale Drehmoment beurteilt Verwendung eines Ergometers die richtig studiert Festigkeitsprüfung Parameter erhoben der Einsatz in Forschung und klinischen Einrichtungen 23.
Elektrische Nervenstimulation kann in einer Vielzahl von Muskelgruppen (zB Ellbogenbeuger, Handgelenk Flexoren, Kniestrecker, Plantarflexoren) verwendet werden. Allerdings macht Nerven Zugänglichkeit derTechnik schwierig in einigen Muskelgruppen. Die Plantarflexoren, insbesondere Triceps surae (soleus und gastrocnemii) Muskeln, werden häufig in der Literatur 24 untersucht. In der Tat sind diese Muskeln in der Fortbewegung beteiligt sind, rechtfertigt ihre besonderen Interesse. Der Abstand zwischen den Stimulationsstelle und Aufzeichnungselektroden erlaubt die Identifizierung der verschiedenen hervorgerufenen Wellen des Triceps surae Muskeln. Die oberflächliche Teil des N. tibialis posterior in der Kniekehle und die große Anzahl von Spindeln erleichtern die Reflexreaktionen im Vergleich zu anderen Muskeln 24 aufzuzeichnen. Aus diesen Gründen konzentriert sich die aktuell präsentierten Reflex Methodik auf der Triceps surae Gruppe von Muskeln (soleus und gastrocnemius). Das Ziel des Protokolls ist es daher, perkutan Nervenstimulationstechnik zu beschreiben, die neuromuskuläre Funktion im Trizeps Surae untersuchen.
Protocol
Representative Results
Discussion
Perkutane Nervenstimulation ermöglicht die Quantifizierung der zahlreiche Merkmale des neuromuskulären Systems nicht nur die grundlegende Steuerung der neuromotorischen Funktion bei gesunden Menschen zu verstehen, aber auch um akute oder chronische Anpassungen durch Materialermüdung oder Ausbildung 17 zu analysieren. Dies ist sehr vorteilhaft insbesondere für ermüdend Protokolle, wo Messungen sind nach der Übung, so schnell wie möglich durchgeführt werden, um die Auswirkungen der raschen Wiedergewinnu…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors have no acknowledgements.
Materials
| Biodex dynamometer | Biodex Medical System Inc., New York, USA | www.biodex.com | |
| MP150 Data Acquisition System | Biopac Systems Inc., Goleta, USA | ||
| Acknowledge 4.1.0 software | Biopac Systems Inc., Goleta, USA | www.biopac.com | |
| DS7A constant current high voltage stimulator | Digitimer, Hertfordshire, UK | www.digitimer.com | |
| Silver chloride surface electrodes | Control Graphique Medical, Brie-Comte-Robert, France | ||
| Computer | |||
| 1 Cable for connecting the Biodex to the MP150 | |||
| 1 Cable for connecting the Digitimer to the MP150 | |||
| 1 Cable for connecting the MP150 to the computer |
References
- Desmedt, J. E., Hainaut, K. Kinetics of myofilament activation in potentiated contraction staircase phenomenon in human skeletal muscle. Nature. 217 (5128), 529-532 (1968).
- Bouisset, S., Maton, B. Quantitative relationship between surface EMG and intramuscular electromyographic activity in voluntary movement. American Journal of Physical Medicine. 51 (6), 285-295 (1972).
- Gabriel, D. A. Effects of monopolar and bipolar electrode configurations on surface EMG spike analysis. Medical Engineering and Physics. 33 (9), 1079-1085 (2011).
- Merletti, R., Rainoldi, A., Farina, D. Surface electromyography for noninvasive characterization of muscle. Exercise and Sport Sciences Reviews. 29 (1), 20-25 (2001).
- Lepers, R. Aetiology and time course of neuromuscular fatigue during prolonged cycling exercises. Science, & Motricité. 52, 83-107 (2004).
- Baudry, S., Klass, M., Pasquet, B., Duchateau, J. Age related fatigability of the ankle dorsiflexor muscles during concentric and eccentric contractions. European Journal of Applied Physiology. 100 (5), 515-525 (2007).
- Place, N., Yamada, T., Bruton, J. D., Westerblad, H. Muscle fatigue From observations in humans to underlying mechanisms studied in intact single muscle fibres. European Journal of Applied Physiology. 110 (1), 1-15 (2010).
- Scaglioni, G., Narici, M. V., Maffiuletti, N. A., Pensini, M., Martin, A. Effect of ageing on the electrical and mechanical properties of human soleus motor units activated by the H reflex and M wave. The Journal of Physiology. 548 (Pt. 2), 649-661 (2003).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Pierrot Deseilligny, E., Burke, D. . The circuitry of the human spinal cord: its role in motor control and movement disorders. , (2005).
- Duclay, J., Pasquet, B., Martin, A., Duchateau, J. Specific modulation of corticospinal and spinal excitabilities during maximal voluntary isometric shortening and lengthening contractions in synergist muscles. The Journal of Physiology. 589 (Pt. 11), 2901-2916 (2011).
- Grosprêtre, S., Papaxanthis, C., Martin, A. Modulation of spinal excitability by a sub threshold stimulation of M1 area during muscle lengthening. 신경과학. 263, 60-71 (2014).
- Mynark, R. G. Reliability of the soleus H reflex from supine to standing in young and elderly. Clinical Neurophysiology. 116 (6), 1400-1404 (2005).
- Palmieri, R. M., Hoffman, M. A., Ingersoll, C. D. Intersession reliability for H reflex measurements arising from the soleus peroneal and tibialis anterior musculature. The International Journal of Neuroscience. 112 (7), 841-850 (2002).
- Chen, Y. S., Zhou, S., Cartwright, C., Crowley, Z., Baglin, R., Wang, F. Test retest reliability of the soleus H reflex is affected by joint positions and muscle force levels. Journal of Electromyography and Kinesiology. 20 (5), 987-987 (2010).
- Lehman, G. J., McGill, S. M. The importance of normalization in the interpretation of surface electromyography A proof of principle. Journal of Manipulative and Physiological Therapeutics. 22 (7), 444-446 (1999).
- Lepers, R. Interest and limits of percutaneous nerve electrical stimulation in the evaluation of muscle fatigue. Science, & Motricité. 70 (70), 31-37 (2010).
- Merton, P. A. Voluntary strength and fatigue. The Journal of Physiology. 123, 553-564 (1954).
- Gandevia, S. C. Spinal and supraspinal factors in human muscle fatigue. Physiological Reviews. 81 (4), 1725-1789 (2001).
- Shield, A., Zhou, S. Assessing voluntary muscle activation with the twitch interpolation technique. Sports Medicine. 34 (4), 253-267 (2004).
- Rozand, V., Pageaux, B., Marcora, S. M., Papaxanthis, C., Lepers, R. Does mental exertion alter maximal muscle activation. Frontiers in Human Neuroscience. 8, 755 (2014).
- Place, N., Maffiuletti, N. A., Martin, A., Lepers, R. Assessment of the reliability of central and peripheral fatigue after sustained maximal voluntary contraction of the quadriceps muscle. Muscle and Nerve. 35 (4), 486-495 (2007).
- Kannus, P. Isokinetic evaluation of muscular performance: implications for muscle testing and rehabilitation. International Journal of Sports Medicine. 15, S11-S18 (1994).
- Tucker, K. J., Tuncer, M., Türker, K. S. A review of the H reflex and M wave in the human triceps surae. Human Movement Science. 24 (5-6), 667-688 (2005).
- Taylor, N. A., Sanders, R. H., Howick, E. I., Stanley, S. N. Static and dynamic assessment of the Biodex dynamometer. European Journal of Applied Physiology and Occupational Physiology. 62 (3), 180-188 (1991).
- Sale, D., Quinlan, J., Marsh, E., McComas, A. J., Belanger, A. Y. Influence of joint position on ankle plantarflexion in humans. Journal of Applied Physiology. 52 (6), 1636-1642 (1982).
- Cattagni, T., Martin, A., Scaglioni, G. Is spinal excitability of the triceps surae mainly affected by muscle activity or body position. Journal of Neurophysiology. 111 (12), 2525-2532 (2014).
- Gerilovsky, L., Tsvetinov, P., Trenkova, G. Peripheral effects on the amplitude of monopolar and bipolar H-reflex potentials from the soleus muscle. Experimental Brain Research. 76 (1), 173-181 (1989).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Hermens, H. J., Freriks, B., Disselhorst Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. Journal of Electromyography and Kinesiology. 10 (5), 361-374 (2000).
- Kamen, G., Sison, S. V., Du, C. C., Patten, C. Motor unit discharge behavior in older adults during maximal effort contractions. Journal of Applied Physiology. 79 (6), 1908-1913 (1995).
- Neyroud, D., Rüttimann, J., et al. Comparison of neuromuscular adjustments associated with sustained isometric contractions of four different muscle groups. Journal of Applied Physiology. 114, 1426-1434 (2013).
- Rupp, T., Girard, O., Perrey, S. Redetermination of the optimal stimulation intensity modifies resting H-reflex recovery after a sustained moderate-intensity muscle contraction. Muscle and Nerve. 41 (May), 642-650 (2010).
- Zehr, E. P. Considerations for use of the Hoffmann reflex in exercise studies. European Journal of Applied Physiology. 86 (6), 455-468 (2002).
- Gondin, J., Duclay, J., Martin, A. Soleus and gastrocnemii evoked V wave responses increase after neuromuscular electrical stimulation training. Journal of Neurophysiology. 95 (6), 3328-3335 (2006).
- Rochette, L., Hunter, S. K., Place, N., Lepers, R. Activation varies among the knee extensor muscles during a submaximal fatiguing contraction in the seated and supine postures. Journal of Applied Physiology. 95 (4), 1515-1522 (2003).
- Fuglevand, A. J., Zackowski, K. M., Huey, K. A., Enoka, R. M. Impairment of neuromuscular propagation during human fatiguing contractions at submaximal forces. The Journal of Physiology. 460, 549-572 (1993).
- Vandervoort, A. A., McComas, A. J. Contractile changes in opposing muscles of the human ankle joint with aging. Journal of Applied Physiology. 61 (1), 361-367 (1986).
- Grosprêtre, S., Martin, A. Conditioning effect of transcranial magnetic stimulation evoking motor evoked potential on V wave response. Physiological Reports. 2 (11), e12191 (2014).
- Allen, G. M., Gandevia, S. C., McKenzie, D. K. Reliability of measurements of muscle strength and voluntary activation using twitch interpolation. Muscle and Nerve. 18 (6), 593-600 (1995).
- Cooper, M. A., Herda, T. J., Walter Herda, A. A., Costa, P. B., Ryan, E. D., Cramer, J. T. The reliability of the interpolated twitch technique during submaximal and maximal isometric muscle actions. Journal of Strength and Conditioning Research. 27 (10), 2909-2913 (2013).
- Froyd, C., Millet, G. Y., Noakes, T. D. The development of peripheral fatigue and short term recovery during self paced high intensity exercise. The Journal of Physiology. 591 (Pt 5), 1339-1346 (2013).
- Pierrot Deseilligny, E., Morin, C., Bergego, C., Tankov, N. Pattern of group I fibre projections from ankle flexor and extensor muscles in man. Experimental Brain Research. 42 (3-4), 337-350 (1981).
- Brooke, J. D., McIlroy, W. E., et al. Modulation of H reflexes in human tibialis anterior muscle with passive movement. Brain Research. 766 (1-2), 236-239 (1997).
- Hultborn, H., Meunier, S., Morin, C., Pierrot Deseilligny, E. Assessing changes in presynaptic inhibition of I a fibres a study in man and the cat. The Journal of Physiology. 389, 729-756 (1987).
- Meunier, S., Pierrot Deseilligny, E. Cortical control of presynaptic inhibition of Ia afferents in humans. Experimental Brain Research. 119 (4), 415-426 (1998).
- Aymard, C., Baret, M., Katz, R., Lafitte, C., Pénicaud, A., Raoul, S. Modulation of presynaptic inhibition of la afferents during voluntary wrist flexion and extension in man. Experimental Brain Research. 137 (1), 127-131 (2001).
- Abbruzzese, G., Trompetto, C., Schieppati, M. The excitability of the human motor cortex increases during execution and mental imagination of sequential but not repetitive finger movements. Experimental Brain Research. 111 (3), 465-472 (1996).
- Garland, S. J., Klass, M., Duchateau, J. Cortical and spinal modulation of antagonist coactivation during a submaximal fatiguing contraction in humans. Journal of Neurophysiology. 99, 554-563 (2008).
- Rodriguez Falces, J., Place, N. Recruitment order of quadriceps motor units Femoral nerve vs direct quadriceps stimulation. European Journal of Applied Physiology. 113, 3069-3077 (2013).
- Rodriguez Falces, J., Maffiuletti, N. A., Place, N. Spatial distribution of motor units recruited during electrical stimulation of the quadriceps muscle versus the femoral nerve. Muscle and Nerve. 48 (November), 752-761 (2013).
- Bathien, N., Morin, C. Comparing variations of spinal reflexes during intensive and selective attention (author’s transl). Physiology, & Behavior. 9 (4), 533-538 (1972).
- Earles, D. R., Koceja, D. M., Shively, C. W. Environmental changes in soleus H reflex excitability in young and elderly subjects. The International Journal of Neuroscience. 105 (1-4), 1-13 (2000).
- Paquet, N., Hui Chan, C. W. Human soleus H reflex excitability is decreased by dynamic head and body tilts. Journal of Vestibular Research Equilibrium, & Orientation. 9 (5), 379-383 (1999).
- Miyahara, T., Hagiya, N., Ohyama, T., Nakamura, Y. Modulation of human soleus H reflex in association with voluntary clenching of the teeth. Journal of Neurophysiology. 76 (3), 2033-2041 (1996).
- Pinniger, G. J., Nordlund, M. M., Steele, J. R., Cresswell, a. GH reflex modulation during passive lengthening and shortening of the human triceps surae. Journal of Physiology. 534 (Pt 3), 913-923 (2001).
- Tallent, J., Goodall, S., Hortobágyi, T., St Clair Gibson, A., French, D. N., Howatson, G. Repeatability of corticospinal and spinal measures during lengthening and shortening contractions in the human tibialis anterior muscle). PLoS ONE. 7 (4), e35930 (2012).
- Grospretre, S., Martin, A. H. reflex and spinal excitability methodological considerations. Journal of Neurophysiology. 107 (6), 1649-1654 (2012).
- Hugon, M. Methodology of the Hoffmann reflex in man. New Developments in Electromyography and Chemical Neurophysiology. 3m, 277-293 (1973).
- Bigland Ritchie, B., Zijdewind, I., Thomas, C. K. Muscle fatigue induced by stimulation with and without doublets. Muscle and Nerve. 23 (9), 1348-1355 (2000).
- Kent Braun, J. A., Le Blanc, R. Quantitation of central activation failure during maximal voluntary contractions in humans. Muscle and Nerve. 19 (7), 861-869 (1996).
- Herbert, R. D., Gandevia, S. C. Twitch interpolation in human muscles mechanisms and implications for measurement of voluntary activation. Journal of Neurophysiology. 82, 2271-2283 (1999).
- Miller, M., Downham, D., Lexell, J. Superimposed single impulse and pulse train electrical stimulation A quantitative assessment during submaximal isometric knee extension in young healthy men. Muscle and Nerve. 22 (8), 1038-1046 (1999).
- Button, D. C., Behm, D. G. The effect of stimulus anticipation on the interpolated twitch technique. Journal of Sports Science and Medicine. 7 (4), 520-524 (2008).
- Goss, D. a., Hoffman, R. L., Clark, B. C. Utilizing Transcranial Magnetic Stimulation to Study the Human Neuromuscular System. Journal of Visualized Experiments. (59), e3387 (2012).
- Sartori, L., Betti, S., Castiello, U. Corticospinal excitability modulation during action observation. Journal Of Visualized Experiments: Jove. (82), 51001 (2013).
- Rozand, V., Lebon, F., Papaxanthis, C., Lepers, R. Does a mental training session induce neuromuscular fatigue. Medicine and Science in Sports and Exercise. 46 (10), 1981-1989 (2014).
- Rozand, V., Cattagni, T., Theurel, J., Martin, A., Lepers, R. Neuromuscular fatigue following isometric contractions with similar torque time integral. International Journal of Sports Medicine. 36, 35-40 (2015).
- Belanger, A. Y., McComas, A. J. Extent of motor unit activation during effort. Journal of Applied Physiology. 51 (5), 1131-1135 (1981).
- Morse, C. I., Thom, J. M., Davis, M. G., Fox, K. R., Birch, K. M., Narici, M. V. Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. European Journal of Applied Physiology. 92 (1-2), 219-226 (2004).
- Dalton, B. H., McNeil, C. J., Doherty, T. J., Rice, C. L. Age related reductions in the estimated numbers of motor units are minimal in the human soleus. Muscle and Nerve. 38 (3), 1108-1115 (2008).
- Hunter, S. K., Todd, G., Butler, J. E., Gandevia, S. C., Taylor, J. L. Recovery from supraspinal fatigue is slowed in old adults after fatiguing maximal isometric contractions. Journal of Applied Physiology. 105 (4), 1199-1209 (2008).
- Jakobi, J. M., Rice, C. L. Voluntary muscle activation varies with age and muscle group. Journal of Applied Physiology. 93 (2), 457-462 (2002).
- Lepers, R., Millet, G. Y., Maffiuletti, N. a Effect of cycling cadence on contractile and neural properties of knee extensors. Medicine and Science in Sports and Exercise. 33 (11), 1882-1888 (2001).
- Duchateau, J., Hainaut, K. Isometric or dynamic training differential effects on mechanical properties of a human muscle. Journal of Applied Physiology. 56 (2), 296-301 (1984).
- Millet, G. Y., Martin, V., Martin, A., Vergès, S. Electrical stimulation for testing neuromuscular function From sport to pathology. European Journal of Applied Physiology. 111, 2489-2500 (2011).
- Cattagni, T., Scaglioni, G., Laroche, D., Van Hoecke, J., Gremeaux, V., Martin, A. Ankle muscle strength discriminates fallers from non fallers. Frontiers in Aging Neuroscience. 6, 336 (2014).
- Horstman, A. M., Beltman, M. J., et al. Intrinsic muscle strength and voluntary activation of both lower limbs and functional performance after stroke. Clinical Physiology and Functional Imaging. 28 (4), 251-261 (2008).
- Sica, R. E., Herskovits, E., Aguilera, N., Poch, G. An electrophysiological investigation of skeletal muscle in Parkinson’s disease. Journal of the Neurological Sciences. 18 (4), 411-420 (1973).
- Knikou, M., Mummidisetty, C. K. Locomotor Training Improves Premotoneuronal Control after Chronic Spinal Cord Injury. Journal of Neurophysiology. 111 (11), 2264-2275 (2014).

