등쪽 마우스 피부에서 헤어 난포 줄기 세포와 표피 각질 형성 세포를 분리
Summary
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Abstract
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introduction
성체 줄기 세포 (SCS는) 죽어가는 세포를 대체하여 조직의 항상성 유지 부상에 손상된 조직을 복구에 필수적이다. 이 희주는 지속적인 자기 갱신을 받아야하고 다양한 세포 계통 1-3로 분화 할 수있는 능력으로 정의된다. 그 보급 용 성인으로 SC에 좌우되는 최고의 조사 시스템은, 조혈 시스템, 소장 및 피부 1,2,4을 포함한다.
배아 발생 동안, 피부 표피 세포의 단일 층으로 시작한다. 중간 엽 세포가 피부를 채우고 기초 콜라겐 진피 (5)을 형성 할 때 모낭 (HF)의 형태 형성이 시작됩니다. 아래쪽 6 성장하기 시작 머리 placodes을 형성 후에 모유두 (DP)를 구성하는 표피층 바로 아래 조직 및 상피 세포를 자극하는 중간 엽 세포를 전문. 높은 HF의 하부에 위치한 기질 세포를 증식,내층 모발 (HS) 및 주변 내측 근초 (IRS) 2,3-을 형성하는 동심의 실린더로 분화되기 시작하면서,이 중간 엽 세포 봉투와 모구를 형성한다.
interfollicular 표피 (IFE), 피지선 (SG)와 HF : 출생 후의 생활에서 피부 표피는 세 구획으로 구성되어 있습니다. 항상성의 일정한 상태에있는 IFE SG와 대조적으로, HF 연속 성장주기 (성장기) 파괴 (퇴행기)과 나머지 (텔로 겐) -4,7-를 거쳐 동적 미니 기관이다. 모낭 줄기 세포 (HFSCs)이 연료이 영구 사이클은 팽창 4로 알려진 HF 내 전문 틈새에 있습니다. 민주당에서 활성화 신호를 상기 HFSCs은 팽창을 종료 성장기 다음 중 증식을 시작하고 아래로하여 외부 루트 시스로 알려진 세포의 긴 선형 흔적을 만들어 내려 (ORS) 8-10. 매트릭스 셀, 즉HF를 빠르게 순환베이스에서 DP를 둘러싸고 따라서 HS 및 IRS (10) (도 1)를 생성하는 단말 분화를 겪고 상향 이동한다. 성장기의 기간은 모발의 길이를 결정하고, 행렬 셀 (6)의 증식 및 분화 능력에 의존한다. HF가 퇴행기 들어가면 전구 중단의 전송 증폭 매트릭스 세포 증식 아폽토시스를 겪게하고이 HF 8,11의 비 사이클의 부분에 도달 할 때까지 위쪽으로 DP 당기는 동안 완전히 퇴행한다. 이 후퇴하는 동안 HF는 퇴행기의 특징 상피 가닥으로 알려진 임시 구조를 형성하고, 많은 사멸 세포를 포함한다. 마우스에서, 퇴행기 3-4 일 간 지속 높은 제 헤어 사이클에서 동기화된다. HF는 휴지기에 도달하면 모든 HFSCs이 정지된다. HF 사이클의 구별 단계는 m에 의해 마우스의 피부의 색의 변화에 의해 특징 지어진다elanin 생산. 퇴행기 동안 어두운 회색으로 성장기 동안 검은 색의 피부 변화는 휴지기 6,7,12,13 동안 핑크합니다.
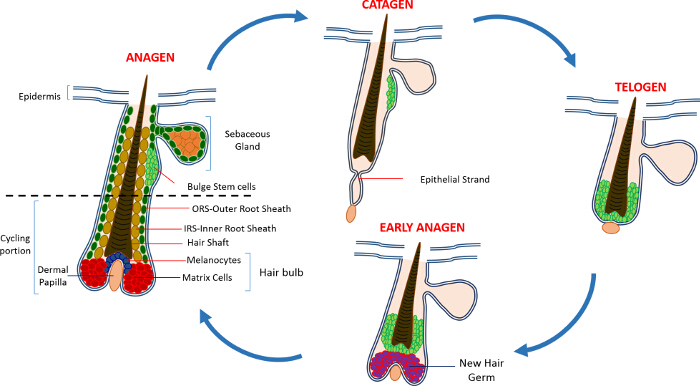
그림 1 : 헤어 난포주기. HF는 영구 상부의 구성과 빠른 성장 (성장기), 파괴 (퇴행기) 및 상대 정지 단계 또는 휴식 (휴지기)의 연속 사이클을 겪는다 낮은 지속적으로 리모델링, 자전거 부분은.되어 더 큰 보려면 여기를 클릭하십시오 이 그림의 버전입니다.
HF를 유지 희주는 처음에 그냥 SG (14) 아래 HF의 영구 지역에 거주 느린 자전거 레이블 유지 셀 (LRC)의 인구를 밝혀 삼중 티미 딘와 체이스 실험을 이용하여 확인 하였다. HFSC의 발전특성은 HF 틈새 (15)로부터 특정 희주를 식별하고 분리하는 데 사용할 수있는 마커의 작은 숫자를 한 것으로 밝혀졌습니다. 아마도 HFSCs의 농축을위한 최선의 마커 CD34, 또한 인체 (16)의 조혈 SC 마커로 확인 된 세포 표면 마커이다. 이 CD34 + 집단 내에서 두 가지 인구는 고립 α6의 인테그린 식 2를 기반으로하고있다. 또 다른 마커 CD34의 발현과 공동-지역화 및 K15 프로모터 타겟팅 및 형질 전환 동물 15,17-19에 HFSCs 분리에 사용되는, 각질이 높은 팽창 영역에 표현 15 (K15)입니다. 지난 10 년 HFSCs 및 선조 세포의 여러 가지 다른 별개 집단은 또한 HF 17,20-27 내에 상주하는 것으로보고되었다.
HFSCs의 또 다른 흥미로운 기능은 피부 복구에 기여한다. 정상적인 조건에서 HFSCs는 HF를 보충하고 IFE 항상성에 참여하지 않습니다. 하우버전은 상처에 대한 응답으로,이 세포는 IFE (9)를 다시 채우기 자신의 SC 틈새 및 지원을 종료합니다. 우리는 최근 마우스는 프로 세포 사멸 Sept4 / 예술 유전자 표시 세포 사멸에 저항을 보여 CD34, K15 및 Sox9 + HFSCs의 증가 수를 삭제할 것을 증명하고있다. HFSCs는 Sept4 / 예술에서 고립되었다 – / – 등의 스킨 정렬 형광 활성 셀 (FACS)를 이용하고 CD34 + 및 K15 + HFSCs의 수보다 두 배 증가가 발생했습니다. 이러한 Sept4 / 예술 – / – HFSCs 시험 관내에서 팽창되지 않은 콜로니는 더 초래했다하지만 컨트롤 (28)에 비하여도 가혹한 조건을 견딜 수 있었다.
HFSCs의 증가를 갖는 결과, Sept4 / 예술 – / – 마우스의 피부 적출 부상에 응답 훨씬 빠르게 치유. 놀랍게도, Sept4 / 예술 – / – 마우스는 displaye상처 침대에서 재생 모발, 상당히 작은 상처 다 많은 수의. 또한, XIAP (세포 사멸의 X-연결 억제제), 예술의 생화학 적 대상에 대한 삭제 마우스는 장애 치유 (28)을 보여 주었다.
우리의 결과와 다른 실험실에서 수행 한 작업은 HFSCs 성인 희주의 생물학 및 기능 연구를위한 이상적인 모델이 될 것으로 나타났습니다. 여기, 우리는 농축 및 HFSCs 네 마커의 발현에 따라 표피 각질 세포의 분리를위한 방법론에 대해 설명합니다 인테그린 α6을; 인테그린 β1; SCA-1 (표피 각질 세포 마커) 및 CD34. K15 + HFSCs 유사한 격리도 K15-GFP 리포터 마우스 (19)를 사용하여 수행 될 수있다.
Protocol
Representative Results
Discussion
여기에 설명 된 프로토콜은 또한 성인 마우스의 등쪽 피부 HFSCs 분리 확립되지만 동일 2,16,23,28,29 마커의 선택에 기초하여, HF 구조 내의 다른 집단의 분리에 적용 할 수있다. 이 방법은 조직 분리 등의 세포 분리의 다른 방법을 통해, 특히 유리하다, 즉의 특정 세포 유형이 선택 될 수 있으며, 이종의 세포 집단의 혼합물로부터 수확. 또한, 여기에 기재된 방법은 빠르고 안정적이며 사용 …
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materials
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | – | – | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | – | – | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | – | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | – | – | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | – | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | – | |
| Distilled H2O | – | – | |
| Stir bar | – | – | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
References
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).

