Dorsal Fare Cilt Saç Folikül Kök Hücreler ve epidermal keratinositler Ayırma
Summary
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Abstract
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introduction
Yetişkin kök hücreleri (SC'ler) ölen hücrelerin yerine doku vücut dengesinin sürdürülmesinde ve yaralanma üzerine hasarlı dokuların onarımı için gereklidir. Bu SC'ler sürekli kendini yenileme geçmesi ve çeşitli hücre soyları 1-3 ayırt etme yetenekleri ile tanımlanmıştır. Kendi ikmal için yetişkin SC'ler bağlıdır iyi çalışılan sistemler, hematopoetik sistem, bağırsak ve cilt 1,2,4 bulunmaktadır.
embriyojenez sırasında cilt epidermal hücrelerin tek bir tabaka olarak başlar. Mezenkimal hücreler cilt doldurmak ve altta yatan kollajen dermis 5 oluşturduklarında saç folikülü (HF) morfonogenezi başlar. Aşağıya doğru 6 büyümeye başlar saç placodes oluşturmak için daha sonra, dermal papilla (DP) oluşturan epidermal tabakasının altında doğrudan organize etmek ve epitel teşvik mezenkimal hücreler, uzman. Son derece HF alt kısmında yer alan matris hücreleri, çoğalan,iç katman saç şaft (HS) ve çevresindeki iç kök kılıfı (IRS) 2,3 oluşturmak için konsantrik silindir içine ayırt etmeye başlar ise, bu mezenkimal hücreler zarf ve saç ampul oluştururlar.
interfolliküler epidermis (IFE), yağ bezi (SG) ve HF: doğum sonrası hayatta deri epidermis üç bölmeden oluşmaktadır. Homeostasis sürekli bir durumdadır IFE ve SG aksine, HF sürekli büyüme döngüleri (anagen), yıkım (katagen) ve geri kalanı (telojen) 4,7 uğrar dinamik bir mini organdır. Kıl folikülü kök hücreleri (HFSCs) yakıt bu daimi döngüsü, şişkinlik 4 olarak bilinen HF içinde özel bir niş bulunur. DP etkinleştirme sinyalleri HFSCs şişkinliği çıkış anajen takip sırasında proliferasyon başlar ve aşağı doğru ve böylece dış kök kılıf olarak bilinen hücrelerin uzun lineer iz oluşturma alçalma (ORS) 8-10. Matris hücreleri, yaniHF, hızla döngüsünün üssünde DP'yi çevreleyen ve böylece HS ve IRS 10 (Şekil 1) üreten terminal farklılaşma geçiren yukarı göç. Anagen süresi saç uzunluğunu belirler ve matriks hücrelerinin 6 çoğalma ve farklılaşma kapasitesine bağlıdır. HF katagen girer zaman, ampul ateşkes transit yalıtım matris hücreler çoğalmaya apoptoz geçmesi ve HF 8,11 olmayan bisiklet parçası ulaşıncaya kadar yukarı DP çekerken tamamen gerileme. Bu geri çekme sırasında HF katagen karakteristik epitel iplikçik olarak bilinen geçici bir yapı oluşturur, ve çok sayıda apoptotik hücre içerir. Farelerde, katagen 3-4 arasındaki gün sürer ve son derece ilk saç döngüsünde eşitlenir. HF telojen ulaştığında tüm HFSCs pasif hale gelir. HF döngüsünün farklı aşamaları da m bağlı fare deri rengine değişiklikler ile karakterize edilirelanin üretimi. Katagen sırasında koyu gri anagen sırasında siyah deri değişiklikleri telojen 6,7,12,13 sırasında pembe.
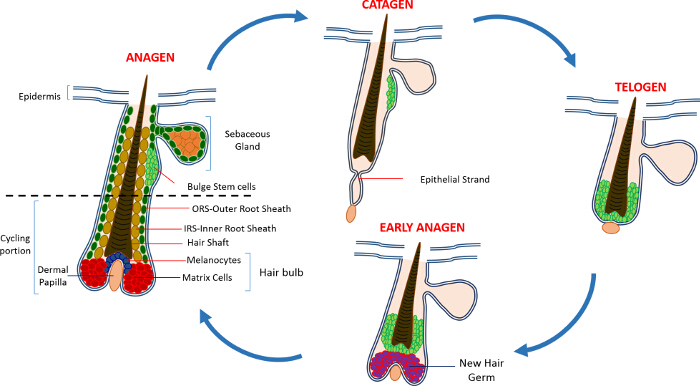
Şekil 1: Saç Folikül Döngüsü. HF kalıcı üst kısmının oluşan ve hızlı büyüme (anagen), yıkım (katagen) ve göreli bir sessizlik fazı veya geri kalanı (telojen) sürekli döngülerine maruz düşük sürekli yeniden yapılanma, bisiklet bölümü. Olan bir büyük görmek için tıklayınız Bu rakamın sürümü.
HF muhafaza SC'ler başlangıçta sadece SG 14 altında HF daimi bölgesinde ikamet yavaş bisiklet etiket istinat hücreler (LRC) nüfusu ortaya öğütülmüş ümidin ile kovalamaca deneyleri, kullanılarak belirlendi. HFSC gelişmelerKarakterizasyon HF niş 15 belirli SC'ler belirlemek ve izole etmek için kullanılabilir belirteçlerin az sayıda tespit edildi. Belki HFSCs zenginleştirilmesi için iyi markör CD34, aynı zamanda, insanlarda 16 bir hematopoietik SC markör olarak tanımlanan bir hücre yüzey markörüdür. Bu CD34 + nüfus içinde iki ayrı nüfus da izole α6 integrin ekspresyonu 2 dayalı olmuştur. Başka bir belirteç CD34 ekspresyonu ile birlikte lokalize ve K-15 promoteri hedefleme ve transgenik hayvanlarda 15,17-19 içinde HFSCs izole edilmesi için kullanılan, keratin yüksek şişiklik bölgesinde ifade edilir 15 (K15) 'dir. Geçtiğimiz on yıl içinde HFSCs ve projenitör hücrelerin birçok farklı popülasyonlar da HF 17,20-27 içinde yer bildirilmiştir.
HFSCs ek heyecan verici özelliği cilt onarım katkıları olduğunu. Normal şartlar altında HFSCs HF doldurmak ve IFE homeostazındaki yer almazlar. However yaralama yanıt olarak, bu hücreler IFE 9 repopulating kendi SC niş ve yardım çıkar. Son zamanlarda fareler pro-apoptotik Sept4 / sanat geni gösterim için apoptoza bir direnç gösterir CD34, 15 K ve SOX9 + HFSCs, artmış sayıda silinmiş göstermiştir. HFSCs Sept4 / sanat izole edilmiştir – / – dorsal derileri Kontrol THP (FACS) kullanılarak CD34 + ve K15 + HFSCs sayısının fazla iki kat daha yüksek olmuştur. Bunlar Sept4 / SANAT – / – HFSCs in vitro genişletilmiş ve değil sadece daha koloniler doğurdu ama kontrollere 28 ile karşılaştırıldığında aynı zamanda sert koşullarına dayanacak şekilde başardık.
HFSCs artan sayısına sahip bir sonucu olarak, Sept4 / sanat – / – farelerinin, deri eksizyon yaralanmaları yanıt olarak önemli ölçüde daha hızlı iyileşti. Çarpıcı, Sept4 / SANAT – / – fareler displayeyara yatağından rejenere HFS ve önemli ölçüde daha küçük izleri da çok sayıda. Ayrıca, XIAP (apoptoz X'e bağlı inhibitörü), SANAT biyokimyasal hedefi için silinen fareler bozulmuş iyileşme 28 gösterdi.
Bizim sonuçları ve diğer laboratuarlarda yapılan çalışma HFSCs yetişkin SC'ler biyolojisi ve fonksiyonu eğitim için ideal bir model olarak hizmet olduğunu göstermiştir. Burada, zenginleştirme ve HFSCs dört markerlerin ekspresyonu göre epidermal keratinositler izolasyonu için bir yöntem açıklanmaktadır: integrin α6; integrin β1; Sca-1 (epidermal keratinositler için bir belirteç) ve CD34. K15 + HFSCs Benzer bir ayrılma K15-GFP raportör fare 19 kullanılarak da gerçekleştirilebilir.
Protocol
Representative Results
Discussion
Burada açıklanan protokol de yetişkin farelerin dorsal deri HFSCs izole etmek için kurulan, ancak aynı belirteç 2,16,23,28,29 seçimine göre, HF yapısı içindeki bir başka popülasyonlarının izole edilmesi için uygulanabilir. Bu yöntem, örneğin, doku ayrışma hücre izolasyonu için diğer yöntemler, içinde özellikle avantajlıdır, bu belirli bir hücre tipi seçilebilir ve heterojen hücre popülasyonu, bir karışımından toplanır. Bundan başka, burada tarif edilen yöntem, hızlı v…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materials
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | – | – | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | – | – | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | – | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | – | – | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | – | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | – | |
| Distilled H2O | – | – | |
| Stir bar | – | – | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
References
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).

