Isoler follicule pileux cellules souches et kératinocytes épidermiques de la peau Dorsale Souris
Summary
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Abstract
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introduction
Les cellules souches adultes (SC) sont essentiels pour maintenir l'homéostasie tissulaire en remplaçant les cellules meurent et la réparation des tissus endommagés lors d'une lésion. Ces SCs sont définis par leur capacité à subir l' auto-renouvellement continu et de se différencier en diverses lignées cellulaires 1-3. Les systèmes les plus étudiés, qui dépendent SCs adultes pour leur reconstitution comprennent le système hématopoïétique, l'intestin et le 1,2,4 cutané.
Au cours de l'embryogenèse, la peau commence par une seule couche de cellules épidermiques. Morphogénèse du follicule pileux (HF) commence lorsque les cellules mésenchymateuses peuplent la peau et forment un derme sous – jacent collagènes 5. Spécialisée des cellules mésenchymateuses, qui constituent la suite de la papille dermique (DP), organisent directement sous la couche de l' épiderme et stimulent l'épithélium pour former placodes cheveux qui commencent à se développer vers le bas 6. Fortement la prolifération des cellules de la matrice, situés à la partie inférieure du HF,envelopper ces cellules mésenchymateuses et forment le bulbe du cheveu, tandis que la couche intérieure commence à se différencier en cylindres concentriques pour former la tige pilaire (HS) et la gaine intérieure entourant la racine (IRS) 2,3.
Dans la vie postnatale l'épiderme de la peau est composé de trois compartiments: l'épiderme interfolliculaires (IFE), la glande sébacée (SG) et le HF. Contrairement à l'IFE et SG qui sont dans un état constant de l' homéostasie, la HF est un mini-organe dynamique qui subit des cycles continus de croissance (anagène de), la destruction (catagène) et de repos (télogène) 4,7. Les cellules souches du follicule pileux (HFSCs) que de carburant ce cycle perpétuel, résident dans un créneau spécialisé dans le HF connu sous le renflement 4. Pendant anagène les HFSCs quitter le renflement, après des signaux d'activation de la DP, commencer à proliférer et descendent vers le bas créant ainsi un long sentier linéaire de cellules connues sous le nom de la gaine externe de la racine (ORS) 8-10. Les cellules de la matrice, quientourer la DP à la base de la HF, le cycle rapidement et migrer vers le haut subissant la différenciation terminale générant ainsi le HS et l'IRS 10 (Figure 1). La durée de la phase anagène détermine la longueur des cheveux et dépend de la capacité de prolifération et la différenciation des cellules de la matrice 6. Lorsque le HF pénètre catagène, les cellules de la matrice de transit-amplification du cessez ampoule de proliférer, subissent l' apoptose et régressent entièrement tout en tirant le DP vers le haut jusqu'à ce qu'il atteigne la partie non-cyclique du HF 8,11. Au cours de cette rétraction HF forme une structure temporaire connu sous le brin de l'épithélium, qui est caractéristique de la phase catagène et contient de nombreuses cellules apoptotiques. Chez la souris, catagène dure entre 3-4 jours et est hautement synchronisé dans le premier cycle pilaire. Lorsque le HF atteint télogène tous HFSCs deviennent repos. Les différentes étapes du cycle HF sont également caractérisés par des changements dans la couleur de la peau de la souris, du fait de mproduction elanin. La peau passe du noir au cours de anagène au gris foncé pendant catagène au rose pendant télogène 6,7,12,13.
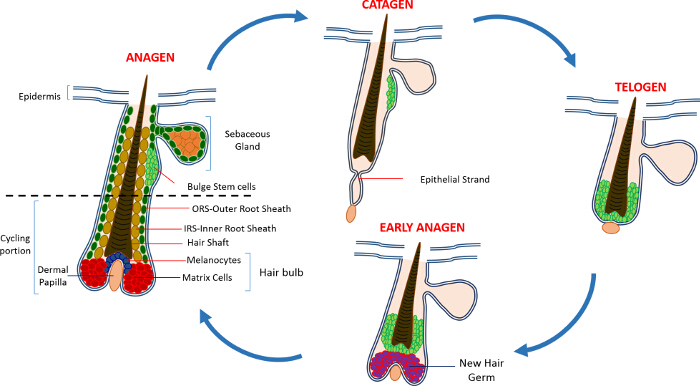
Figure 1: Le cycle follicule pileux. Le HF est composé d'une partie permanente supérieure et, une partie de cyclisme remodelage inférieure constante qui subit des cycles continus de croissance rapide (anagène), la destruction (catagène) et une phase de quiescence relative ou de repos (télogène). S'il vous plaît cliquer ici pour voir une plus grande version de ce chiffre.
Les SCs maintenant la HF ont été initialement identifiés en utilisant des expériences de chasse, avec de la thymidine tritiée, qui a révélé une population de cellules d'étiquettes cycliste lente retenue (LRC) qui résidaient dans la région permanente du HF juste en dessous du SG 14. Advances in HFSCla caractérisation a révélé un petit nombre de marqueurs qui peuvent être utilisés pour identifier et isoler SCs spécifiques de la niche HF 15. Peut-être le meilleur marqueur pour l' enrichissement de HFSCs est CD34, un marqueur de surface cellulaire a également identifié comme un marqueur SC 16 hématopoïétique chez l' homme. Dans ce CD34 + populations deux populations distinctes ont également été isolés sur la base de α6 intégrine expression 2. Un autre marqueur est la kératine 15 (K15) , qui est fortement exprimé dans la région de la bosse, la co-localise avec l' expression du CD34 et un promoteur K15 est utilisé pour le ciblage et l' isolement HFSCs chez des animaux transgéniques 15,17-19. Dans la dernière décennie , plusieurs autres populations distinctes de HFSCs et les cellules progénitrices ont également été signalés à résider dans le HF 17,20-27.
Une caractéristique supplémentaire intéressante de HFSCs est leur contribution à la réparation de la peau. Dans des conditions normales HFSCs reconstituent le HF et ne prennent pas part à IFE homéostasie. However, en réponse à la blessure, ces cellules quitter leur niche de SC et de l' aide à repeupler la IFE 9. Nous avons récemment démontré que les souris supprimés pour l'affichage du gène Sept4 / ARTS pro-apoptotique un nombre accru de CD34, K15 et Sox9 + HFSCs, qui démontrent une résistance à l' apoptose. HFSCs ont été isolés de Sept4 / ARTS – / – peaux dorsales utilisent cellules activées par fluorescence (FACS) et il y avait plus de deux fois plus dans le nombre de CD34 + et K15 + HFSCs. Ces Sept4 / ARTS – / – HFSCs ont été élargis in vitro et non seulement ont donné lieu à plus de colonies , mais sont également capables de résister à des conditions plus sévères par rapport aux témoins 28.
En conséquence d'avoir un nombre accru de HFSCs, Sept4 / ARTS – / – souris guéries nettement plus rapide en réponse à des blessures d'excision de la peau. Il est frappant, Sept4 / ARTS – / – souris displayeda grand nombre de formations sanitaires régénérées du lit de la plaie, et significativement plus petites cicatrices. En outre, les souris supprimées pour XIAP (inhibiteur lié à l'X de l' apoptose), la cible biochimique des ARTS, ont démontré une mauvaise cicatrisation 28.
Nos résultats et les travaux effectués dans d'autres laboratoires ont montré que HFSCs servent comme un modèle idéal pour étudier la biologie et la fonction de SCs adultes. Ici, nous décrivons la méthode utilisée pour l'enrichissement et l'isolement de HFSCs et kératinocytes de l'épiderme sur la base de l'expression de quatre marqueurs: α6 intégrine; intégrine β1; Sca-1 (un marqueur pour les kératinocytes de l'épiderme) et CD34. Isolement similaire de K15 + HFSCs peut également être effectuée en utilisant le K15-rapporteur GFP 19 souris.
Protocol
Representative Results
Discussion
Le protocole décrit ici est bien établie pour isoler HFSCs de la peau dorsale de souris adulte , mais peut également être appliquée pour isoler des autres populations au sein de la structure de HF, en fonction de la sélection de marqueurs 2,16,23,28,29. Cette méthode est particulièrement avantageuse par rapport à d'autres méthodes d'isolement des cellules, telles que la dissociation des tissus, en ce qu 'un type de cellule spécifique peut être sélectionné et récolté à partir d'…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materials
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | – | – | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | – | – | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | – | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | – | – | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | – | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | – | |
| Distilled H2O | – | – | |
| Stir bar | – | – | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
References
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).

