Come studiare membrana basale Rigidità come biofisica trigger nel cancro alla prostata e altre patologie legate all'età o malattie metaboliche
Summary
Qui spieghiamo un protocollo per modellare il microambiente biofisico dove reticolazione e una maggiore rigidità della membrana basale (BM) indotta da prodotti finali della glicazione avanzata (AGE) ha rilevanza patologica.
Abstract
Qui si descrive un protocollo che può essere utilizzato per studiare il microambiente biofisico relativi a spessore maggiorato e la rigidità della membrana basale (BM) durante le patologie legate all'età e disturbi metabolici (come cancro, diabete, malattie microvascolare, retinopatia, nefropatia e neuropatia) . La premessa del modello è reticolazione non enzimatica della matrice ricostituito BM (RBM) di trattamento con glicolaldeide (GLA) promuovere avanzata glicazione prodotto finale (AGE) generazione tramite la reazione di Maillard. Esempi di tecniche di laboratorio che possono essere utilizzati per confermare la generazione AGE, reticolazione non enzimatica e una maggiore rigidità in GLA trattati meccanismi sono delineati. Questi includono la preparazione di natale RBM (trattato con soluzione salina tamponata con fosfato, PBS) e rigido RBM (trattato con GLA) per la determinazione di: suo contenuto AGE da analisi fotometrica e microscopia a immunofluorescenza, la sua reticolazione non enzimatica da sodio dodecil solfato poliacrilammideelettroforesi su gel (SDS PAGE) e microscopia confocale, e la sua maggiore rigidità utilizzando reometria. Il procedimento qui descritto può essere utilizzato per aumentare la rigidità (moduli elastici, E) di MLF fino a 3,2 volte, in linea con le misurazioni effettuate in sani contro tessuto prostatico umano malato. Per ricreare il microambiente biofisico associato con l'invecchiamento e la prostata malata ghiandola tre tipi di cellule della prostata sono stati introdotti a RBM nativo e rigido RBM: RWPE-1, le cellule epiteliali della prostata (PEC) derivato da una ghiandola prostatica normale; BPH-1, PEC derivati da una ghiandola prostatica affetti da iperplasia prostatica benigna (BPH); e PC3, cellule metastatiche derivate da un tumore osseo secondario proveniente da cancro alla prostata. parametri multipli possono essere misurati, tra cui le dimensioni, la forma e le caratteristiche invasive della acini ghiandolari 3D formato da RWPE-1 e BPH-1 sul nativo contro rigida RBM, e la durata media delle cellule, la velocità migratoria e la persistenza di movimento delle cellule di spher 3DOID formate da cellule PC3 alle stesse condizioni. Cellulare vie di segnalazione e la localizzazione subcellulare delle proteine può anche essere valutato.
Introduction
The basement membrane (BM) is a sheet of specialized extracellular matrix (ECM) that maintains stable tissue borders by separating layers of epithelial cells from the stroma1. Covalent crosslinking between adjacent triple helices of collagen IV in the BM stabilizes their lateral association by establishing an irregular network of super-twisted helices2. These collagen IV lattices act as a scaffold for its interaction with laminin and other BM components1. The structural arrangement of the BM provides it with the mechanical strength and rigidity necessary for the normal development of glandular epithelia3.
During aging and disease the BM progressively thickens and stiffens3,4. For example, a 3-fold increase in the elastic modulus (E) of the ocular BM occurs between the ages of 50 and 80 in the normal population, and this stiffening is further exacerbated in metabolic disorders like diabetes5. The structural and biomechanical changes in the BM that result in its increased stiffness occur when its ECM components, collagen IV and laminin, become non-enzymatically crosslinked following their exposure to advanced glycation endproducts (AGEs).
The purpose of the method described here was to establish a model for the investigation of how BM stiffness, due to AGE exposure, promotes prostate epithelial cell (PEC) and prostate tumour cell (PTC) invasiveness in the context of the switch to metastatic prostate cancer (PCa). To do this a previous method used for generating 3D glandular acini from mammary epithelial cells (MECs) in reconstituted rBM gels6 was adapted to include an additional step where the rBM gels are pre-treated with glycolaldehyde (GLA). Several techniques for assessing GLA induced crosslinking and stiffening of pre-treated rBM gels are described, including photometric analysis, sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS PAGE), confocal microscopy and rheometric analysis. The prostate cell types selected for culture on the pre-stiffened rBM include: RWPE-1, PECs derived from a normal prostate gland7; BPH-1, PECs derived from a prostate gland affected by BPH8; and PC3, metastatic PTCs derived from a secondary tumor located in the vertebral bone of a prostate cancer (PCa) patient9.
In addition to advancing the study of prostate gland pathology, the protocol for stiffening of rBM gels by their treatment with GLA can be adapted to investigate how BM stiffness contributes to other age-related pathologies and metabolic disorders. For example, the model can be directly applied to investigate how metastatic cancer is induced by BM stiffness in organs such as the breast, colon, ovary and pancreas by the incorporation of appropriate cell types. Furthermore, the protocol can be adapted to investigate how stiff BM promotes biomechanical mechanisms of disease progression in diabetes-related microvascular disease, retinopathy, nephropathy and neuropathy.
Protocol
Representative Results
Discussion
Un protocollo per la generazione di acini ghiandolari 3D da MECs a puro gel rbm 6 è stato modificato in uno studio precedente con l'aggiunta di 4 mg tipo / ml collagene alla matrice MLF. L'aggiunta di collagene provocato il modulo elastico del gel meccanismi crescenti da 175 ± 37 al 1589 ± 380 Pascal. Questo aumento 9,1 volte della rigidità modulata la crescita, la sopravvivenza, la migrazione e la differenziazione delle MECs 21. Il protocollo è stato modificato nuovamente includendo una fase di trattamento con D – (-) – ribosio promuovere reticolazione non enzimatica del collagene di tipo I che era stato aggiunto al gel MLF. Il risultante aumento di 15 volte della rigidità è stato trovato a collaborare con la trasformazione oncogenica di MECs per promuovere il loro comportamento invasivo 22. L'approccio sperimentale di tipo aggiunta di collagene di gel RBM facilita l'interazione diretta di MECs con fibre di collagene, che si verifica solo nei tessuti umani dopo la barriera fisica tra lo stromaed epitelio fornite dal BM subisce degradazione proteolitica. Generando acini ghiandolari 3D da PEC in gel puro RBM pre-trattati con GLA, l'attuale protocollo apre la strada per studiare come BM rigidità di per sé in grado di attivare il loro comportamento invasivo (Figura 3). I livelli di BM rigidità indotte in questo protocollo hanno rilevanza fisiologica. L'incubazione con 50 mM GLA per 6 ore e 14 ore, rispettivamente aumentato i moduli elastici del gel puro meccanismi a 175 ± 90 e 322 ± 160 rispetto a 122 ± 55 Pascal in gel MLF trattati con PBS (Tabella 1). Questo aumento 1,7-3,2 volte in RBM rigidità ricapitola il 2,5 a 3,4 volte aumento della rigidità osservato in maligno della prostata rispetto al normale o tessuto di BPH 23-26. Come indicato in una recente pubblicazione 13 le variazioni morfologiche indotte da un accumulo di AGE e RBM rigidità PEC acini può essere quantificato per un cambiamento statisticamente significativo da arounded a forma poligonale, diminuzione del lume / superficie totale acinare, e le cellule sporgenti che migrano dal acina nel ricco-AGE RBM (Figura 3). Immunoblotting può anche essere utilizzato per valutare marcatori di EMT (ad esempio perdita di E-caderina 13) e il comportamento contrattili (es fosforilata leggera della miosina catena 2, pMLC2 13) in PEC coltivati in normale rispetto rigida MLF (Figura 3). Ulteriore valutazione usando immunofluorescenza e microscopia confocale può essere applicata per visualizzare il BM (es laminina, collagene IV e accumulo di AGE 13), cellulare polarità apicale-to-basale (es localizzazione apicale EEA1: primi endosomal antigene 1 e GM130: 130 kDa marcatore cis-Golgi 13) e modelli cellulari di molecole di adesione (es localizzazione e-caderina per giunzioni cellula-cellula 13) (Figura 3).
<img alt = "Figura 3" src = "/ files / ftp_upload / 54230 / 54230fig3.jpg" />
Figura 3:. Panoramica dei diversi protocolli qui presentati Il diagramma illustra come preparare e irrigidire la membrana basale ricostituita (RBM) con glicolaldeide (reazione di Maillard), come seme le cellule al rigida RBM, come analizzare la rigida RBM ( entità della reazione di Maillard) e le procedure che possono essere utilizzate per analizzare i cambiamenti cellulari e molecolari indotte da ricchi-AGE RBM. AGE, prodotti finali della glicazione avanzati; BM, membrana basale; DAPI, 4 ', 6-diamidino-2-phenylindole; EEA1, presto antigene endosomal 1; GAPDH, gliceraldeide-3-fosfato deidrogenasi; GLA, glicolaldeide; GEE, glicina estere etilico; GM130, 130 kDa marcatori cis-Golgi; p-MLC2 (Thr18 / Ser19), miosina luce catena 2 fosforilata in siti treonina 18 e serina 19; RBM, membrana basale ricostituita; SDS-PAGE, sodio dodecil solfato gel di poliacrilammide. Per la barra RWPE1 acini Scala = 10 micron; per cellule tumorali PC3bar sferoidi Scala = 100 micron. Questa cifra è stata modificata dal riferimento 13. Si prega di cliccare qui per vedere una versione più grande di questa figura.
saranno necessari passaggi di risoluzione dei problemi se D – (-) – ribosio viene scelto come agente reticolante per RBM. Durante lo sviluppo del protocollo è stato trovato che il trattamento con 1 M D – (-) – ribosio per 72 ore, come precedentemente descritto per i gel RBM / collagene 22, portato alla disidratazione e ritiro del gel MLF. La valutazione delle concentrazioni inferiori di D – (-) – ribosio e tempi di trattamento più brevi può contribuire a superare questa limitazione.
Un potenziale limitazione future applicazioni del protocollo potrebbe essere incontrata in cui si desiderano livelli più alti di RBM rigidità. Se i tempi di incubazione più lunghi e concentrazioni più elevate di GLA vengono utilizzati per indurre livelli elevati di MLF gel rigidità sarà necessario valutare se tali condizioni di trattamento hanno un impatto sulla sopravvivenza e la proliferazione cellulare, come descritto in precedenza 13. Va inoltre notato che l'incubazione di RWPE-1 le cellule con siero induce una transizione EMT-like fenotipica e l'esposizione a siero o materiali contenenti siero deve essere evitato. Ad esempio, se gli esperimenti riguardano la transfezione di short interfering RNA oligonucleotidi (siRNA), la procedura deve essere ottimizzato usando le cellule RWPE-1 coltivate in KSFM, senza passare le cellule su un supporto a basso siero trasfezione. Questo inconveniente potrebbe compromettere il livello di silenziamento genico ottenuto utilizzando siRNA transitorio si avvicina nel modello. Per alcuni bersagli proteici che sarebbe stato consigliato di utilizzare vettori shRNA inducibili per sintonizzabile silenziamento genico e la diminuzione desiderata in livelli di proteine. Adattamenti che incorporano reticolazione enzimatica da cellule stromali o cellule tumorali lysyl associato ossidasi (LOX) 17 potrebbe anche essere incorporati in modelli futuri.
jove_content "> Questo protocollo faciliterà il futuro studio dei meccanismi pro-invasive attivati da età-dipendente BM rigidità PEC (RWPE-1, BPH-1) e la valutazione degli obiettivi anti-metastatici in PTC invasive (PC3). Dato che BPH è considerato come un disordine metabolico 27, questo protocollo spiana anche la strada verso la nostra migliore comprensione del legame tra disturbi del metabolismo e aumento del rischio di cancro alla prostata. Dato che BM rigidità indotta dalla sua esposizione alle età può essere un innesco per l'invasività in altro cancro tipi, sarà di interesse per utilizzare il protocollo per impostare modelli simili che incorporano normali cellule epiteliali e le cellule tumorali di altri organi (ad esempio seno, del colon, ovaie, pancreas).Passaggi critici all'interno del protocollo, insieme con i loro tempi, sono riassunte nella Figura 4. Durante la fase iniziale, è fondamentale per mantenere la soluzione stock di RBM a 4 ° C, mentre si scioglie per evitare che la sua polymerization. puntali delle pipette non devono essere inseriti nella soluzione rM magazzino fino a quando non sono state refrigerate a 4 ° C. Per il passo successivo è anche importante per garantire i vetrini camera sono equilibrati a 4 ° C prima di essere rivestiti con la soluzione RBM. Appena la temperatura della soluzione MLF è aumentata oltre 4 ° C che a polimerizzazione irreversibile per formare un gel. È essenziale che i meccanismi non è disturbato durante la fase di polimerizzazione per assicurare che forma una superficie piana adatto per coltura cellulare e analisi microscopica. La durata di incubazione con GLA, con o senza inibitori della reazione di Maillard (sodiocianoboroidruro e amingoguanidine) determinerà come il gel rigido RBM diventa. Si consiglia di utilizzare una incubazione 6 ore con GLA se sono richieste condizioni di semi-rigide, e l'incubazione 14 ore se sono necessarie condizioni rigide (Tabella 1). tempi di incubazione alternative o concentrazioni di GLA possono essere usati se diversi livellidi rigidità sono desiderato. In questo caso l'analisi reologiche del gel RBM devono essere incorporato come un passo essenziale. Dopo la fase di tempra reazione di Maillard mediante incubazione con GEE e le successive fasi di lavaggio con PBS, i gel RBM possono essere utilizzati immediatamente o conservati a 4 ° C per un massimo di 48 ore prima del loro utilizzo per colture cellulari. Una volta colture cellulari sono impostati è importante cambiare il terreno di coltura (compresi eventuali trattamenti) ogni due giorni. Si raccomanda di mantenere le colture cellulari 3D per 3-12 giorni secondo i parametri oggetto di indagine. Per 3D PEC acini si consiglia di analizzare le culture dopo 6 giorni, e per il 3D PTC sferoidi analisi è raccomandata dopo 3 giorni di coltura in prima istanza.
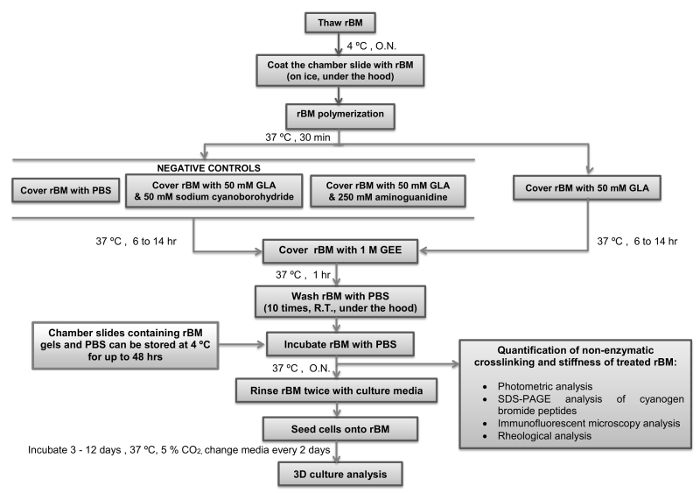
Figura 4:. Semplice Panoramica del protocollo con i punti critici e tempi indicati la floSchema w descrive come preparare e irrigidire la membrana basale ricostituita (RBM) con glicolaldeide (reazione di Maillard) con i punti critici e tempi indicati. Punti in cui il protocollo può essere fermato, e gel RBM conservato, sono indicati anche. RBM, membrana basale ricostituita; GLA, glicolaldeide; GEE, glicina estere etilico; ON, durante la notte; PBS, fosfato tamponata salina; RT, a temperatura ambiente. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Simon Hayward (Vanderbilt University Medical Center) for the BPH-1 cells; and Thomas Cox and Janine Erler (Biotech Research & Innovation Centre, University of Copenhagen) for their assistance with rheological measurements. MR-T was funded by Worldwide Cancer Research, formerly The Association of International Cancer Research (Grant 08-0803 to JS), The British Embassy Montevideo and Agencia Nacional de Investigacion e Innovacion (UK_RH_2015_1_2 to MR-T). MC was supported by Prostate Cancer UK (Grant S14-017 to JS and GS). KW was funded by The China Scholarship Council. MAM was funded by The Saudi Arabian Cultural Bureau.
Materials
| I – Material for monolayer culture | |||
| BPH-1 | CaP Cell Line Database | PCaCL-132 | Contact: simon.hayward@mcmail.vanderbilt.edu |
| Complete keratinocyte serum-free media | ThermoFisher Scientific | 17005-075 | Do not warm at 37 ºC before use |
| Fetal calf serum | First Link UK Ltd | 02-00-850 | Store at -20 ºC in aliquots |
| PC3 | American Type Culture Collection | CRL-1435 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15070-063 | |
| Phosphate Buffer Saline (Dulbecco A) tablets | Oxoid | BR0014G | |
| RPMI 1640 medium | Sigma-Aldrich | R5886 | warm in 37 ºC water bath before use |
| RWPE-1 | American Type Culture Collection | CRL-11609 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Name | Company | Catalog Number | Comments |
| II – Material for 3D culture | |||
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Aminoguanidine hydrochloride | Sigma-Aldrich | 396494 | Irritating to eyes, respiratory system and skin |
| Chamber slides, 8-well | Thermo Scientific Nunc Lab-Tek | TKT-210-816M | |
| Culture Matrix reconstituted basement membrane (rBM) reduced growth factor extract | AMS Biotechnology | 3445-005-01 | Store Basement membrane (BM) at -80 ºC in aliquots |
| Cyanogen bromide | Sigma-Aldrich | C91492 | Toxic by contact skin and inhalation |
| Formic acid | Sigma-Aldrich | 695076 | |
| Glycine ethyl ester hydrochloride (GEE) | Sigma-Aldrich | 50060 | Irritating to eyes |
| Glycolaldehyde dimer (GLA) | Sigma-Aldrich | G6805 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 71435 | Highly flammable; Toxic by contact skin and inhalation |
| Syringe filter 0.22 microns | Appleton Woods | BC680 | |
| Name | Company | Catalog Number | Comments |
| III – Material to quantify Maillard reaction | |||
| 4’,6-diamidino-2-phenylindole (DAPI) | ThemoFisher Scientific | D3571 | light sensitive and store at -20 ºC in aliquots |
| Cloning cylinders | Sigma-Aldrich | C1059 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11001 | light sensitive |
| Goat anti-rabbit IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11034 | light sensitive |
| Goat serum | Abcam | ab7481 | Store at -20 ºC in aliquots |
| Vectashield mounting media | Vector Laboratories | H-1000 | |
| Mouse anti-pentosidine clone PEN-12 mAb | TransGenic Inc | KH012 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | F8775 | Store at -20 ºC in aliquots |
| Rabbit anti-human collagen IV polyclonal antibody | Acris Antibodies | R1041 | Store at -20 ºC in aliquots |
| Rabbit anti-laminin A/C pAb | Santa Cruz Biotechnology Inc | sc-7292 | Store at -20 ºC in aliquots |
| Polyethylene glycol tert-octylphenyl ether (Triton-X100) | Sigma-Aldrich | T9284 | |
| Polyethylene glycol sorbitan monolaurate (Tween-20) | Sigma-Aldrich | P1379 | |
| Dialysis cassette Slide-A-Lyzer | ThemoFisher Scientific | 66333 | |
| Name | Company | Catalog Number | Comments |
| IV – Equipment | |||
| ARG2 controlled strain rotational rheometer | T.A. Instruments | ||
| Axiovert S100 (20x magnification) microscope | Zeiss | ||
| CO2 controlled humidified incubation chamber for Zeiss Axio S100 microscope | Solent Scientific | ||
| Confocal Axiovert 200M (40x, 63x magnification) microscope | Zeiss | ||
| Olympus LH50A microscope fitted with a digital camera using phase-contrast | Olympus | ||
| PHERAstar Plus plate reader spectrophotometer | BMG Labtech | ||
| Name | Company | Catalog Number | Comments |
| V – Software | |||
| Image J 1.47v | National Institute of Health, USA | ||
| MetaXpress | Molecular Divices |
References
- Timpl, R., Brown, J. C. Supramolecular assembly of basement membranes. Bioessays. 18 (2), 123-132 (1996).
- Yurchenco, P. D., Ruben, G. C. Type IV collagen lateral associations in the EHS tumor matrix. Comparison with amniotic and in vitro networks. Am J Pathol. 132 (2), 278-291 (1988).
- Halfter, W., et al. Protein composition and biomechanical properties of in vivo-derived basement membranes. Cell Adh Migr. 7 (1), 64-71 (2013).
- Candiello, J., Cole, G. J., Halfter, W. Age-dependent changes in the structure, composition and biophysical properties of a human basement membrane. Matrix Biol. 29 (5), 402-410 (2010).
- To, M., et al. Diabetes-induced morphological, biomechanical, and compositional changes in ocular basement membranes. Exp Eye Res. 116, 298-307 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Bello, D., Webber, M. M., Kleinman, H. K., Wartinger, D. D., Rhim, J. S. Androgen responsive adult human prostatic epithelial cell lines immortalized by human papillomavirus 18. Carcinogenesis. 18 (6), 1215-1223 (1997).
- Hayward, S. W., et al. Establishment and characterization of an immortalized but non-transformed human prostate epithelial cell line: BPH-1. In Vitro Cell Dev Biol Anim. 31 (1), 14-24 (1995).
- Kaighn, M. E., Narayan, K. S., Ohnuki, Y., Lechner, J. F., Jones, L. W. Establishment and characterization of a human prostatic carcinoma cell line (PC-3). Invest Urol. 17 (1), 16-23 (1979).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76 (9), 4350-4354 (1979).
- Rabilloud, T. Mechanisms of protein silver staining in polyacrylamide gels: a 10-year synthesis. Electrophoresis. 11 (10), 785-794 (1990).
- Rodriguez-Teja, M., et al. AGE-modified basement membrane cooperates with Endo180 to promote epithelial cell invasiveness and decrease prostate cancer survival. J Pathol. 235 (4), 581-592 (2015).
- Graf, B. W., Boppart, S. A. Imaging and analysis of three-dimensional cell culture models. Methods Mol Biol. 591, 211-227 (2010).
- Yao, N. Y., Larsen, R. J., Weitz, D. A. Probing nonlinear rheology with inertio-elastic oscillations. J Rheology. 52 (4), 1013-1025 (2008).
- Baker, A. M., Bird, D., Lang, G., Cox, T. R., Erler, J. T. Lysyl oxidase enzymatic function increases stiffness to drive colorectal cancer progression through FAK. Oncogene. 32 (14), 1863-1868 (2013).
- Caley, M. P., et al. Tumor-associated Endo180 requires stromal-derived LOX to promote metastatic prostate cancer cell migration on human ECM surfaces. Clin Exp Metastasis. 3 (2), 151-165 (2016).
- Sturge, J., Wienke, D., East, L., Jones, G. E., Isacke, C. M. GPI-anchored uPAR requires Endo180 for rapid directional sensing during chemotaxis. J Cell Biol. 162 (5), 789-794 (2003).
- Sturge, J., Wienke, D., Isacke, C. M. Endosomes generate localized Rho-ROCK-MLC2-based contractile signals via Endo180 to promote adhesion disassembly. J Cell Biol. 175 (2), 337-347 (2006).
- Rodriguez-Teja, M., et al. Survival Outcome and EMT Suppression Mediated by a Lectin Domain Interaction of Endo180 and CD147. Mol Cancer Res. 13 (3), 538-547 (2015).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139 (5), 891-906 (2009).
- Carson, W. C., et al. Material characterization of ex vivo prostate tissue via spherical indentation in the clinic. Med Eng Phys. 33 (3), 302-309 (2011).
- Hoyt, K., et al. Tissue elasticity properties as biomarkers for prostate cancer. Cancer Biomark. 4 (4-5), 213-225 (2008).
- Krouskop, T. A., Wheeler, T. M., Kallel, F., Garra, B. S., Hall, T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 20 (4), 260-274 (1998).
- Zhang, M., et al. Quantitative characterization of viscoelastic properties of human prostate correlated with histology. Ultrasound Med Biol. 34 (7), 1033-1042 (2008).
- Corona, G., et al. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol. , (2014).

