Prostat Kanseri ve Diğer Yaşa bağlı Patolojilerde veya Metabolik Hastalıklarda bir Biyofiziksel Tetik olarak Bazal Membran Rijitliğinin Eğitim Nasıl
Summary
Burada çapraz ve ileri glikasyon nihai ürünlerin (AGE) tarafından uyarılan bazal membran (BM) artan sertlik patolojik ilgisi biyofiziksel mikro modelleme için bir protokol açıklar.
Abstract
Burada, yaşa bağlı patolojiler ve metabolik hastalıklar (örneğin, kanser, diyabet, mikrovasküler hastalık, retinopati, nefropati ve nöropati) sırasında artan kalınlığı ve bazal membran (BM) sertliği ile ilgili biyofiziksel mikro-incelemek için kullanılabilecek bir protokol açıklar . modelin öncül Maillard reaksiyonu ile ileri glikasyon son ürün (AGE) üretimini teşvik etmek için glikoladehid (GLA) ile işlenmesi suretiyle yeniden BM (RBM) matrisin enzimatik olmayan çapraz bağlar. YAŞ nesil, non-enzimatik çapraz bağlanmasını onaylamak için kullanılır ve GLA sertliği artırılabilir laboratuvar teknikleri örnekleri RBM özetlenmiştir tedavi. fotometrik analiz ve immünoflüoresan mikroskopi, sodyum dodesil sülfat poliakrilamid tarafından enzimatik olmayan çapraz bağlama ile onun yaş içerik: Bu belirlenmesi için (GLA ile muamele edilmiş) ve sert RBM (fosfat tamponlu tuzlu su, PBS ile muamele edilmiş) yerel RBM hazırlanmasını içerirjel elektroforezi (SDS-PAGE) ve konfokal mikroskopi, ve artan sertlik ile reometre. Burada tarif edilen prosedür, hastalıklı insan prostat dokusu karşı sağlıklı yapılan ölçümler ile uyumlu olarak, 3.2 kata kadar RBM sertliğini (esneklik modülü, E) geliştirmek için de kullanılabilir. yaşlanma ve hastalıklı prostat ile ilişkili biyofiziksel mikro yeniden üç prostat hücre tipleri yerli RBM ve sert RBM için getirilmiştir bezi: RWPE-1, prostat epitel hücreleri (PEC) normal prostat bezinin türetilmiş; BPH-1, benign prostat hiperplazisi (BPH) etkilenen bir prostat bezinin türetilen PECS; ve PC3, metastatik prostat kanseri hücreleri kaynaklanan ikincil kemik tümörü türetilmiş. Birden çok parametre boyut, şekil ve sert RBM karşı doğal ilgili RWPE-1 ve BPH-1 tarafından oluşturulan 3D glandüler asinüs invaziv özellikleri ve ortalama hücre boyu, göç eden hız ve 3D spher hücre hareketinin devam etmesi de dahil olmak üzere, ölçülebiliraynı koşullar altında, PC3 hücrelerinin oluşturduğu Giller. yollar ve proteinlerin hücre içi lokalizasyonu hücre sinyal de değerlendirilebilir.
Introduction
The basement membrane (BM) is a sheet of specialized extracellular matrix (ECM) that maintains stable tissue borders by separating layers of epithelial cells from the stroma1. Covalent crosslinking between adjacent triple helices of collagen IV in the BM stabilizes their lateral association by establishing an irregular network of super-twisted helices2. These collagen IV lattices act as a scaffold for its interaction with laminin and other BM components1. The structural arrangement of the BM provides it with the mechanical strength and rigidity necessary for the normal development of glandular epithelia3.
During aging and disease the BM progressively thickens and stiffens3,4. For example, a 3-fold increase in the elastic modulus (E) of the ocular BM occurs between the ages of 50 and 80 in the normal population, and this stiffening is further exacerbated in metabolic disorders like diabetes5. The structural and biomechanical changes in the BM that result in its increased stiffness occur when its ECM components, collagen IV and laminin, become non-enzymatically crosslinked following their exposure to advanced glycation endproducts (AGEs).
The purpose of the method described here was to establish a model for the investigation of how BM stiffness, due to AGE exposure, promotes prostate epithelial cell (PEC) and prostate tumour cell (PTC) invasiveness in the context of the switch to metastatic prostate cancer (PCa). To do this a previous method used for generating 3D glandular acini from mammary epithelial cells (MECs) in reconstituted rBM gels6 was adapted to include an additional step where the rBM gels are pre-treated with glycolaldehyde (GLA). Several techniques for assessing GLA induced crosslinking and stiffening of pre-treated rBM gels are described, including photometric analysis, sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS PAGE), confocal microscopy and rheometric analysis. The prostate cell types selected for culture on the pre-stiffened rBM include: RWPE-1, PECs derived from a normal prostate gland7; BPH-1, PECs derived from a prostate gland affected by BPH8; and PC3, metastatic PTCs derived from a secondary tumor located in the vertebral bone of a prostate cancer (PCa) patient9.
In addition to advancing the study of prostate gland pathology, the protocol for stiffening of rBM gels by their treatment with GLA can be adapted to investigate how BM stiffness contributes to other age-related pathologies and metabolic disorders. For example, the model can be directly applied to investigate how metastatic cancer is induced by BM stiffness in organs such as the breast, colon, ovary and pancreas by the incorporation of appropriate cell types. Furthermore, the protocol can be adapted to investigate how stiff BM promotes biomechanical mechanisms of disease progression in diabetes-related microvascular disease, retinopathy, nephropathy and neuropathy.
Protocol
Representative Results
Discussion
Saf RBM jeller 6 MECS 3D glandüler asinüs üretilmesi için bir protokol I RBM matrise kolajen 4 mg / ml tip eklenmesiyle yapılan bir çalışmada değiştirildi. kollajen eklenmesi 1589 ± 380 Pascal 175 ± 37 artan RBM jel elastik modül ile sonuçlanmıştır. Sertlik Bu 9.1 katlık bir artış MECS 21 büyüme, hayatta kalma, göç ve farklılaşmayı modüle. – (-) – RBM jele ilave edilmiştir tip I kollajenin enzimatik olmayan çapraz bağlanmasını teşvik etmek riboz Protokol D ile muamele aşaması içerecek şekilde tekrar modifiye edildi. Sertlik Elde edilen 15 kat artış onların invaziv davranış 22 teşvik etmek MECS onkojenik dönüşümü ile işbirliği bulunmuştur. Ben RBM jeller kollajenin ekleme Çeşidi deneysel yaklaşım sadece stroma arasındaki fiziksel bariyer sonra insan dokusunda meydana kolajen lifleri ile MECS doğrudan etkileşimi kolaylaştırırve BM sağladığı epitel proteolitik bozulmaya uğrar. Saf RBM jeller GLA ile ön işlemden de Halk 3D bez asinüsü üreterek, mevcut protokol BM sertliği başına onların invaziv davranış (Şekil 3) tetikleyebilir nasıl incelemek için bir yol açar. Bu protokol kaynaklı BM sertlik seviyeleri fizyolojik alaka var. 6 saat, 14 saat süre ile, 50 mM GLA ile inkübasyon, sırasıyla PBS (Tablo 1) ile muamele RBM jeller 122 ± 55 Pascal göre 175 ± 90 ve 322 ± 160 saf RBM jel elastik modülü artmıştır. RBM sertliği bu 1,7-3,2 misli artış normal prostatta ve BPH dokusunun 23-26 ile karşılaştırıldığında habis gözlenen sertlik 2.5- 3.4-kat artış tartışıldı. Son yayında PEC asini YAŞ ve RBM sertlik birikimi ile oluşturulan 13 morfolojik değişiklikler belirtildiği gibi ar dan istatistiksel olarak anlamlı vardiyası için sayısal olabilirçokgen şekline ounded luminal / toplam asinar alan ve yaş bakımından zengin RBM (Şekil 3) içerisine acina taşıma çıkıntı yapan hücrelerin azalmıştır. İmmünoblotting da EMT belirteçleri değerlendirmek ve kasılma davranışı (örneğin fosforlu miyosin hafif zincir-2, pMLC2 13) sert RBM normale karşı yetiştirilen Halk (Şekil 3) (E-kadherin 13 örneğin kaybı) kullanılabilir. 130: ve GM130 erken endozomal antijeni 1: immünofloresan boyama ve konfokal mikroskopi kullanılarak daha fazla değerlendirilmesi (örneğin, laminin, kolajen IV ve AGE birikimi 13), hücresel apikal-to-bazal polarite (örneğin, apikal EEA1 lokalizasyonu BM görselleştirmek için uygulanabilir kDa sis-Golgi işaretleyici 13) ve yapışma moleküllerinin hücre modelleri (hücre-hücre kavşaklarından 13 örneğin e-kaderin yerelleştirme) (Şekil 3).
<img alt = "Şekil 3" src = "/ files / ftp_upload / 54230 / 54230fig3.jpg" />
Şekil 3:. Burada sunulan Farklı Protokoller genel şeması (hazırlamak ve glikoladehid (Maillard reaksiyonu) ile yeniden bazal membran (RBM), sert RBM için hücreleri tohum nasıl nasıl sert RBM analiz pekiştirmek için nasıl tasvir Maillard reaksiyonu), ve yaş bakımından zengin RBM neden olduğu hücresel ve moleküler değişimleri analiz etmek için kullanılabilir prosedürlerin ölçüde. YAŞ, gelişmiş Glikasyon Son; BM, bazal membran; DAPI, 4 ', 6-diamidino-2-fenilindol; EEA1 erken endozomal antijeni 1; GAPDH, gliseraldehid-3-fosfat dehidrojenaz, GLA izleyerek, sulu; GEE glisin etil ester; GM130, 130 kDa'lık bir sis-Golgi işaretleyici; p-MLC2 (Thr18 / Ser19), miyozin hafif zincir-2 siteleri fosforile 18 ve serin 19 treonine; RBM, tekrar oluşturulmuş temel membran; SDS-PAGE sodyum dodesil sülfat poliakrilamid jel elektroforezi. RWPE1 acininin Ölçek çubuğu = 10 mm; PC3 tümör hücresi içinSferoidler Ölçek çubuğu = 100 mikron. Bu rakam referans 13 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
– (-) – Riboz RBM için çapraz bağlama maddesi olarak seçilmiştir D ise giderme adımları gereklidir. – (-) – 72 saat boyunca riboz, daha önce RBM / kollajen jel 22 için tarif edildiği gibi, RBM jeller dehidrasyon ve çekme ile sonuçlanmıştır protokolü gelişimi sırasında, 1 M, D ile tedavi olduğu bulunmuştur. – (-) – D düşük konsantrasyonlarda değerlendirilmesi riboz ve daha kısa tedavi süreleri bu sınırlamayı aşmak için yardımcı olabilir.
RBM sertlik yüksek seviyelerde arzu nerede protokol gelecekteki uygulamalar bir potansiyel sınırlama karşılaştı olabilir. uzun inkübasyon süreleri ve GLA'nın daha yüksek konsantrasyonlar RBM jel sertliği yüksek seviyelerini indüklemek için, kullanılacak ise gerekli olacaktır Bu tedavi koşulları hücrenin hayatta kalması ve çoğalması üzerinde bir etkisi olup olmadığını önceden 13 açıklandığı gibi, değerlendirmek. Ayrıca, serum ile RWPE-1 hücrelerinin inkübasyon kaçınılmalıdır serum veya serum ihtiva eden malzeme, bir fenotipik EMT benzeri geçiş ve maruz indükler unutulmamalıdır. Deneyler kısa RNA (siRNA) oligonükleotidleri müdahale transfeksiyonunu içeren, örneğin, işlemin düşük serum transfeksiyon ortamı hücrelerin geçmeden KSFM yetiştirilen RWPE-1 hücreleri kullanılarak optimize edilmelidir. geçici siRNA kullanılarak modelde yaklaştığında genin seviyesini tehlikeye atabilecek Bu dezavantajı elde susturulması. Bazı protein hedefleri için ayarlanabilir gen susturma ve protein düzeyleri istenen düşüşün indüklenebilir shRNA vektörler istihdam için tavsiye edilir. Stromal hücre veya tümör hücresi bağlantılı lisil oksidaz (LOX) 17 enzimatik çapraz bağlanmasını dahil uyarlamalar da gelecek modelleri içine dahil edilebilir.
jove_content "> Bu protokol yanlısı invaziv Halk AGE-bağımlı BM sertliği tarafından tetiklenen mekanizmaların (RWPE-1, BPH-1) ve invaziv PTCs (PC3) anti-metastatik hedeflerin değerlendirilmesi gelecekteki çalışma kolaylaştıracaktır. BPH göz önüne alındığında bir metabolik bozukluk 27 olarak kabul edilir, bu protokol aynı zamanda metabolik bozukluklar ve artan prostat kanseri riski arasındaki bağlantıyı bizim daha iyi anlaşılması yönünde önünü açıyor. AGEs onun maruz tarafından uyarılan BM sertlik diğer kanser invazivlik için bir tetikleyici olabilir göz önüne alındığında türleri, diğer organların (örneğin meme, kolon, yumurtalık, pankreas) normal epitel hücreleri ve tümör hücrelerini birleştirmek benzer modeller kurmak için protokolünü kullanmak için ilgi olacaktır.Birlikte zamanlamaları ile bir protokol dahilinde kritik adımlar, Şekil 4'te özetlenmiştir. İlk aşamasında o onun pol önlemek için thaws ise 4 ° C'de RBM stok solüsyonu korumak için esastırymerization. bunlar, 4 ° C'ye soğutulmuş kadar pipet uçları rM hazır çözelti içine yerleştirilmesi gerekir. Bir sonraki adım için bunların RBM çözeltisi ile kaplanır önce bölmeli lamlar 4 ° C'ye dengelenmiş emin olmak için önemlidir. En kısa RBM çözeltinin sıcaklığı, 4 ° C üzerinde bir artış gibi bir jel oluşturmak için geri dönüşü olmayan bir polimerizasyon geçirecektir. Temel RBM bir daha da hücre kültürü ve mikroskobik analizi için uygun bir yüzey oluşturur sağlamak için polimerleştirme aşamasında rahatsız olduğunu. veya Maillard reaksiyonu (sodyum siyanoborohidrit ve amingoguanidine) önleyicileri olmayan GLA ile inkübasyon süresi RBM jel haline kadar sert belirleyecektir. Sert koşullar (Tablo 1) gerekiyorsa Yarı sert koşullar gerekiyorsa GLA ile 6 saat inkübasyon kullanılması tavsiye ve 14 saat inkübasyon edilir. GLA Alternatif inkübasyon süreleri veya konsantrasyonları farklı düzeylerde ise kullanılabilirsertliğin arzu edilir. RBM jellerinin Bu durumda, reolojik analizde temel bir adım olarak dahil edilmesi gerekir. GEE ile inkübasyon ve PBS ile müteakip yıkama adımları ile Maillard reaksiyonu söndürülmesi adımını takiben, RBM jeller hemen kullanılabilir ya da önceki hücre kültürü için kullanımı ile en fazla 48 saat boyunca 4 ° C'de saklanır. hücre kültürleri ayarlandıktan sonra her iki gün (herhangi bir tedavi de dahil olmak üzere), kültür ortamı değiştirmek önemlidir. Araştırma altındaki parametrelerine göre 3-12 gün için 3 boyutlu hücre kültürleri korumak için tavsiye edilir. 3D için PEC 6 gün sonra kültürleri analiz etmek tavsiye ve 3D PTC ilk etapta kültür 3 gün sonra tavsiye edilir analiz sferoidler için olan asinüsü.
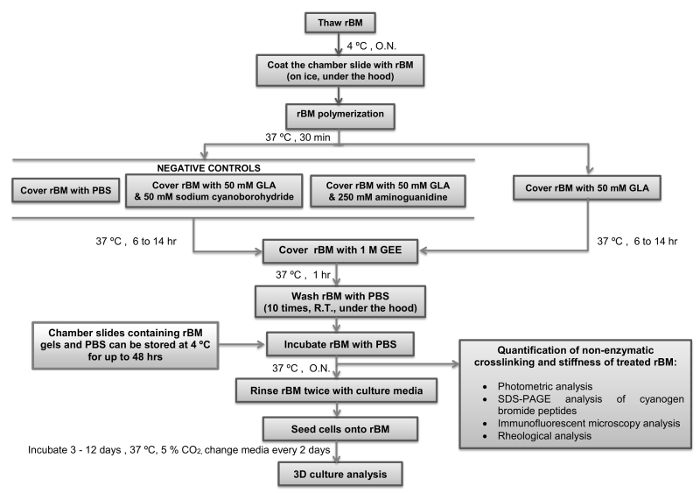
Şekil 4:. Kritik Adımlar ve Zamanlamaları'na ile Protokol Basit Bakış gösterilen flow şeması hazırlamak ve belirtilen kritik adımlar ve zamanlamaları ile glikoladehid (Maillard reaksiyonu) ile yeniden bazal membran (RBM) pekiştirmek için nasıl göstermektedir. Protokol durdurulabilir ve RBM jeller saklanan Nokta de belirtilmiştir. RBM, tekrar oluşturulmuş temel membran; GLA izleyerek, sulu; GEE glisin etil ester; AÇIK, gecede; PBS, fosfat tamponlu salin; RT, oda sıcaklığı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Simon Hayward (Vanderbilt University Medical Center) for the BPH-1 cells; and Thomas Cox and Janine Erler (Biotech Research & Innovation Centre, University of Copenhagen) for their assistance with rheological measurements. MR-T was funded by Worldwide Cancer Research, formerly The Association of International Cancer Research (Grant 08-0803 to JS), The British Embassy Montevideo and Agencia Nacional de Investigacion e Innovacion (UK_RH_2015_1_2 to MR-T). MC was supported by Prostate Cancer UK (Grant S14-017 to JS and GS). KW was funded by The China Scholarship Council. MAM was funded by The Saudi Arabian Cultural Bureau.
Materials
| I – Material for monolayer culture | |||
| BPH-1 | CaP Cell Line Database | PCaCL-132 | Contact: simon.hayward@mcmail.vanderbilt.edu |
| Complete keratinocyte serum-free media | ThermoFisher Scientific | 17005-075 | Do not warm at 37 ºC before use |
| Fetal calf serum | First Link UK Ltd | 02-00-850 | Store at -20 ºC in aliquots |
| PC3 | American Type Culture Collection | CRL-1435 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15070-063 | |
| Phosphate Buffer Saline (Dulbecco A) tablets | Oxoid | BR0014G | |
| RPMI 1640 medium | Sigma-Aldrich | R5886 | warm in 37 ºC water bath before use |
| RWPE-1 | American Type Culture Collection | CRL-11609 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Name | Company | Catalog Number | Comments |
| II – Material for 3D culture | |||
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Aminoguanidine hydrochloride | Sigma-Aldrich | 396494 | Irritating to eyes, respiratory system and skin |
| Chamber slides, 8-well | Thermo Scientific Nunc Lab-Tek | TKT-210-816M | |
| Culture Matrix reconstituted basement membrane (rBM) reduced growth factor extract | AMS Biotechnology | 3445-005-01 | Store Basement membrane (BM) at -80 ºC in aliquots |
| Cyanogen bromide | Sigma-Aldrich | C91492 | Toxic by contact skin and inhalation |
| Formic acid | Sigma-Aldrich | 695076 | |
| Glycine ethyl ester hydrochloride (GEE) | Sigma-Aldrich | 50060 | Irritating to eyes |
| Glycolaldehyde dimer (GLA) | Sigma-Aldrich | G6805 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 71435 | Highly flammable; Toxic by contact skin and inhalation |
| Syringe filter 0.22 microns | Appleton Woods | BC680 | |
| Name | Company | Catalog Number | Comments |
| III – Material to quantify Maillard reaction | |||
| 4’,6-diamidino-2-phenylindole (DAPI) | ThemoFisher Scientific | D3571 | light sensitive and store at -20 ºC in aliquots |
| Cloning cylinders | Sigma-Aldrich | C1059 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11001 | light sensitive |
| Goat anti-rabbit IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11034 | light sensitive |
| Goat serum | Abcam | ab7481 | Store at -20 ºC in aliquots |
| Vectashield mounting media | Vector Laboratories | H-1000 | |
| Mouse anti-pentosidine clone PEN-12 mAb | TransGenic Inc | KH012 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | F8775 | Store at -20 ºC in aliquots |
| Rabbit anti-human collagen IV polyclonal antibody | Acris Antibodies | R1041 | Store at -20 ºC in aliquots |
| Rabbit anti-laminin A/C pAb | Santa Cruz Biotechnology Inc | sc-7292 | Store at -20 ºC in aliquots |
| Polyethylene glycol tert-octylphenyl ether (Triton-X100) | Sigma-Aldrich | T9284 | |
| Polyethylene glycol sorbitan monolaurate (Tween-20) | Sigma-Aldrich | P1379 | |
| Dialysis cassette Slide-A-Lyzer | ThemoFisher Scientific | 66333 | |
| Name | Company | Catalog Number | Comments |
| IV – Equipment | |||
| ARG2 controlled strain rotational rheometer | T.A. Instruments | ||
| Axiovert S100 (20x magnification) microscope | Zeiss | ||
| CO2 controlled humidified incubation chamber for Zeiss Axio S100 microscope | Solent Scientific | ||
| Confocal Axiovert 200M (40x, 63x magnification) microscope | Zeiss | ||
| Olympus LH50A microscope fitted with a digital camera using phase-contrast | Olympus | ||
| PHERAstar Plus plate reader spectrophotometer | BMG Labtech | ||
| Name | Company | Catalog Number | Comments |
| V – Software | |||
| Image J 1.47v | National Institute of Health, USA | ||
| MetaXpress | Molecular Divices |
References
- Timpl, R., Brown, J. C. Supramolecular assembly of basement membranes. Bioessays. 18 (2), 123-132 (1996).
- Yurchenco, P. D., Ruben, G. C. Type IV collagen lateral associations in the EHS tumor matrix. Comparison with amniotic and in vitro networks. Am J Pathol. 132 (2), 278-291 (1988).
- Halfter, W., et al. Protein composition and biomechanical properties of in vivo-derived basement membranes. Cell Adh Migr. 7 (1), 64-71 (2013).
- Candiello, J., Cole, G. J., Halfter, W. Age-dependent changes in the structure, composition and biophysical properties of a human basement membrane. Matrix Biol. 29 (5), 402-410 (2010).
- To, M., et al. Diabetes-induced morphological, biomechanical, and compositional changes in ocular basement membranes. Exp Eye Res. 116, 298-307 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Bello, D., Webber, M. M., Kleinman, H. K., Wartinger, D. D., Rhim, J. S. Androgen responsive adult human prostatic epithelial cell lines immortalized by human papillomavirus 18. Carcinogenesis. 18 (6), 1215-1223 (1997).
- Hayward, S. W., et al. Establishment and characterization of an immortalized but non-transformed human prostate epithelial cell line: BPH-1. In Vitro Cell Dev Biol Anim. 31 (1), 14-24 (1995).
- Kaighn, M. E., Narayan, K. S., Ohnuki, Y., Lechner, J. F., Jones, L. W. Establishment and characterization of a human prostatic carcinoma cell line (PC-3). Invest Urol. 17 (1), 16-23 (1979).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76 (9), 4350-4354 (1979).
- Rabilloud, T. Mechanisms of protein silver staining in polyacrylamide gels: a 10-year synthesis. Electrophoresis. 11 (10), 785-794 (1990).
- Rodriguez-Teja, M., et al. AGE-modified basement membrane cooperates with Endo180 to promote epithelial cell invasiveness and decrease prostate cancer survival. J Pathol. 235 (4), 581-592 (2015).
- Graf, B. W., Boppart, S. A. Imaging and analysis of three-dimensional cell culture models. Methods Mol Biol. 591, 211-227 (2010).
- Yao, N. Y., Larsen, R. J., Weitz, D. A. Probing nonlinear rheology with inertio-elastic oscillations. J Rheology. 52 (4), 1013-1025 (2008).
- Baker, A. M., Bird, D., Lang, G., Cox, T. R., Erler, J. T. Lysyl oxidase enzymatic function increases stiffness to drive colorectal cancer progression through FAK. Oncogene. 32 (14), 1863-1868 (2013).
- Caley, M. P., et al. Tumor-associated Endo180 requires stromal-derived LOX to promote metastatic prostate cancer cell migration on human ECM surfaces. Clin Exp Metastasis. 3 (2), 151-165 (2016).
- Sturge, J., Wienke, D., East, L., Jones, G. E., Isacke, C. M. GPI-anchored uPAR requires Endo180 for rapid directional sensing during chemotaxis. J Cell Biol. 162 (5), 789-794 (2003).
- Sturge, J., Wienke, D., Isacke, C. M. Endosomes generate localized Rho-ROCK-MLC2-based contractile signals via Endo180 to promote adhesion disassembly. J Cell Biol. 175 (2), 337-347 (2006).
- Rodriguez-Teja, M., et al. Survival Outcome and EMT Suppression Mediated by a Lectin Domain Interaction of Endo180 and CD147. Mol Cancer Res. 13 (3), 538-547 (2015).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139 (5), 891-906 (2009).
- Carson, W. C., et al. Material characterization of ex vivo prostate tissue via spherical indentation in the clinic. Med Eng Phys. 33 (3), 302-309 (2011).
- Hoyt, K., et al. Tissue elasticity properties as biomarkers for prostate cancer. Cancer Biomark. 4 (4-5), 213-225 (2008).
- Krouskop, T. A., Wheeler, T. M., Kallel, F., Garra, B. S., Hall, T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 20 (4), 260-274 (1998).
- Zhang, M., et al. Quantitative characterization of viscoelastic properties of human prostate correlated with histology. Ultrasound Med Biol. 34 (7), 1033-1042 (2008).
- Corona, G., et al. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol. , (2014).

