Como Estudar Basement Membrane Rigidez como um gatilho Biofísica no cancro da próstata e outras patologias relacionadas com a idade ou Doenças Metabólicas
Summary
Aqui nós explicar um protocolo para modelar o microambiente biofísico onde reticulação e o aumento da rigidez da membrana basal (BM) induzida por produtos finais de glicação avançada (AGEs) tem relevância patológica.
Abstract
Descrevemos aqui um protocolo que pode ser utilizado para estudar o microambiente biofísico relacionadas ao aumento da espessura e rigidez da membrana basal (BM) durante patologias relacionadas com a idade e distúrbios metabólicos (por exemplo, cancro, diabetes, doença microvascular, retinopatia, nefropatia e neuropatia) . A premissa de que o modelo é de ligação cruzada não enzimática de BM matriz reconstituído (RBM), por tratamento com glicolaldeído (GLA) para promover a glicação avançada produto final geração (FGA), através da reacção de Maillard. Exemplos de técnicas laboratoriais que podem ser utilizados para confirmar a geração de AGE, a reticulação não enzimática e aumento da rigidez em GLA tratada RBM são descritas. Estes incluem a preparação de MAE nativa (tratados com solução salina tamponada com fosfato, PBS) e rígida RBM (tratadas com GLA) para a determinação de: o seu conteúdo de AGE por análise fotométrica e de microscopia de imunofluorescência, a sua ligação cruzada não enzimática de poliacrilamida de sulfato de dodecilo de sódioelectroforese em gel (SDS-PAGE), bem como microscopia confocal, e a sua rigidez aumentada utilizando reometria. O processo descrito aqui pode ser utilizado para aumentar a rigidez (módulos elásticos, E) de MAE-se para 3,2 vezes, consistente com as medições efectuadas em saudável contra o tecido da próstata humano doente. Para recriar o microambiente biofísico associado ao envelhecimento e próstata doente glândula três tipos de células da próstata foram introduzidas para RBM nativa e dura RBM: RWPE-1, células epiteliais da próstata (PECs) derivada de uma próstata normal; HBP-1, PEC derivadas de uma próstata afectados por hiperplasia prostática benigna (BPH); e PC3, células metastáticas derivado de um tumor ósseo secundário proveniente de cancro da próstata. Vários parâmetros podem ser medidos, incluindo o tamanho, forma e características invasoras do acini glandular 3D formado por RWPE-1 e BPH-1 no nativa contra RBM duro, e duração média de células, a velocidade de migração e persistência de circulação de células de spher 3Doids formados por células PC3 sob as mesmas condições. Vias celular e a localização subcelular de proteínas de sinalização pode igualmente ser avaliada.
Introduction
The basement membrane (BM) is a sheet of specialized extracellular matrix (ECM) that maintains stable tissue borders by separating layers of epithelial cells from the stroma1. Covalent crosslinking between adjacent triple helices of collagen IV in the BM stabilizes their lateral association by establishing an irregular network of super-twisted helices2. These collagen IV lattices act as a scaffold for its interaction with laminin and other BM components1. The structural arrangement of the BM provides it with the mechanical strength and rigidity necessary for the normal development of glandular epithelia3.
During aging and disease the BM progressively thickens and stiffens3,4. For example, a 3-fold increase in the elastic modulus (E) of the ocular BM occurs between the ages of 50 and 80 in the normal population, and this stiffening is further exacerbated in metabolic disorders like diabetes5. The structural and biomechanical changes in the BM that result in its increased stiffness occur when its ECM components, collagen IV and laminin, become non-enzymatically crosslinked following their exposure to advanced glycation endproducts (AGEs).
The purpose of the method described here was to establish a model for the investigation of how BM stiffness, due to AGE exposure, promotes prostate epithelial cell (PEC) and prostate tumour cell (PTC) invasiveness in the context of the switch to metastatic prostate cancer (PCa). To do this a previous method used for generating 3D glandular acini from mammary epithelial cells (MECs) in reconstituted rBM gels6 was adapted to include an additional step where the rBM gels are pre-treated with glycolaldehyde (GLA). Several techniques for assessing GLA induced crosslinking and stiffening of pre-treated rBM gels are described, including photometric analysis, sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS PAGE), confocal microscopy and rheometric analysis. The prostate cell types selected for culture on the pre-stiffened rBM include: RWPE-1, PECs derived from a normal prostate gland7; BPH-1, PECs derived from a prostate gland affected by BPH8; and PC3, metastatic PTCs derived from a secondary tumor located in the vertebral bone of a prostate cancer (PCa) patient9.
In addition to advancing the study of prostate gland pathology, the protocol for stiffening of rBM gels by their treatment with GLA can be adapted to investigate how BM stiffness contributes to other age-related pathologies and metabolic disorders. For example, the model can be directly applied to investigate how metastatic cancer is induced by BM stiffness in organs such as the breast, colon, ovary and pancreas by the incorporation of appropriate cell types. Furthermore, the protocol can be adapted to investigate how stiff BM promotes biomechanical mechanisms of disease progression in diabetes-related microvascular disease, retinopathy, nephropathy and neuropathy.
Protocol
Representative Results
Discussion
Um protocolo para a geração de ácinos glandular 3D a partir de CME em géis RBM puros 6 foi modificada em um estudo anterior pela adição de 4 mg / ml tipo I colágeno para matriz RBM. A adição de colagénio resultou no módulo de elasticidade do gel RBM aumento de 175 ± 37-1589 ± 380 Pascais. Este aumento de 9,1 vezes na rigidez modulado o crescimento, sobrevivência, migração e diferenciação das CMEs 21. O protocolo foi modificado de novo através da inclusão de um passo de tratamento com D – (-) – ribose para promover a reticulação não enzimática do colagénio do tipo I, que tinha sido adicionado ao gel RBM. O resultante aumento de 15 vezes na rigidez foi encontrado para cooperar com a transformação oncogénica de MECs para promover o seu comportamento invasivo 22. A abordagem experimental do tipo adicionando I colágeno para géis RBM facilita a interação direta do CME com fibras de colágeno, o que só ocorre no tecido humano após a barreira física entre o estromae epitélio fornecida pela BM sofre degradação proteolítica. Ao gerar ácinos glandular 3D a partir de PECs em géis RBM puros pré-tratados com GLA, o protocolo atual abre o caminho para estudar como BM rigidez per se pode acionar o seu comportamento invasivo (Figura 3). Os níveis de BM rigidez induzidas neste protocolo tem relevância fisiológica. A incubação com GLA 50 mM durante 6 h e 14 h, respectivamente, aumentou os módulos elásticos do gel RBM pura para 175 ± 90 e 322 ± 160 em comparação com 122 ± 55 Pascais em géis RBM tratados com PBS (Tabela 1). Este aumento de 1,7 a 3,2 vezes em RBM rigidez recapitula a 2,5 a 3,4 vezes aumento na rigidez observada em comparação com maligno da próstata normal ou o tecido de BPH 23-26. Conforme descrito em uma publicação recente 13 as alterações morfológicas induzidas pela acumulação de AGE e RBM rigidez no PEC ácinos pode ser quantificada para uma mudança estatisticamente significante de arundada de forma poligonal, diminuição luminal / área total acinar, e as células salientes migram do acina no-AGE rica RBM (Figura 3). Imunotransferência também pode ser usado para avaliar os marcadores de EMT (por exemplo, perda de E-caderina 13) e o comportamento contráctil (por exemplo leve da miosina de cadeia fosforilada-2, pMLC2 13) em PEC cultivadas em normais versus RBM rígida (Figura 3). A avaliação subsequente por meio da coloração de imunofluorescência e microscopia confocal podem ser aplicadas para visualizar o BM (por exemplo, a laminina, colagénio IV e acumulação de AGE 13), a polaridade apical-para-basal celular (por exemplo, localização apical EEA1: antigénio endossomal precoce 1; e GM130: 130 kDa cis-Golgi marcador 13) e padrões de moléculas de adesão celular (por exemplo, a e-caderina de localização para junções célula-célula 13) (Figura 3).
<img alt = "Figura 3" src = "/ files / ftp_upload / 54230 / 54230fig3.jpg" />
Figura 3:. Visão geral dos diferentes protocolos aqui apresentados O diagrama mostra como preparar e endurecer a membrana basal reconstituída (RBM) com glicoaldeído (reação de Maillard), como propagar células para a RBM rígida, como analisar o RBM rígido ( extensão da reacção de Maillard) e procedimentos que podem ser utilizados para analisar as alterações celulares e moleculares induzidos por RBM rica em produtos FGA. AGE, produtos finais da glicação avançada; BM, membrana basal; DAPI, 4 ', 6-diamidino-2-fenilindol; EEA1, cedo antigénio endossomal 1; GAPDH, gliceraldeído-3-fosfato desidrogenase; GLA, glicoaldeído; GEE, éster etílico de glicina; GM130, 130 kDa marcadores cis-Golgi; p-MLC2 (Thr18 / Ser19), miosina de cadeia leve 2 fosforilada em locais treonina 18 e serina 19; RBM, membrana basal reconstituída; SDS-PAGE, electroforese em dodecil sulfato de gel de poliacrilamida de sódio. Para bar RWPE1 ácinos Escala = 10 mm; para células de tumor PC3barra de escala = esferóides 100 um. Esta figura foi modificado a partir da referência 13. Por favor clique aqui para ver uma versão maior desta figura.
solução de problemas etapas será necessário se D – (-) – ribose é escolhido como o agente de ligação cruzada para RBM. Durante o desenvolvimento do protocolo, verificou-se que o tratamento com 1 M D – (-) – ribose durante 72 horas, como descrito anteriormente para géis RBM / colágeno 22, resultou na desidratação e encolhimento dos géis RBM. A avaliação de concentrações mais baixas de D – (-) – ribose e tempos de tratamento mais curtos pode ajudar a ultrapassar esta limitação.
Uma limitação potencial em futuras aplicações do protocolo pode ser encontrado em níveis mais elevados de RBM rigidez são desejados. Se os tempos de incubação mais longos e maiores concentrações de GLA são utilizados para induzir níveis mais elevados de rigidez de gel RBM será necessário avaliar se estas condições de tratamento ter um impacto sobre a sobrevivência e proliferação celular, tal como previamente descrito 13. Deve também notar-se que a incubação de células RWPE-1 com soro induz uma transição EMT-fenotípica e como a exposição a soro ou materiais contendo soro deve ser evitada. Por exemplo, se experiências envolvem a transfecção de ARN interferente curto oligonucleótidos (siARN), o procedimento deve ser optimizada utilizando células RWPE-1 cultivadas em KSFM, sem mudar as células para meio de transfecção baixo soro. Este inconveniente pode comprometer o nível de silenciamento de genes obtidos quando utilizando siRNA transiente abordagens no modelo. Para algumas proteínas alvo, seria aconselhável empregar vectores shRNA induzíveis para o silenciamento do gene ajustável ea redução desejada em níveis de proteína. Adaptações que incorporam reticulação enzimática por células do estroma ou células de tumor associado lisil-oxidase (LOX) 17 também poderia ser incorporada modelos futuros.
jove_content "> Este protocolo facilitará o futuro estudo de mecanismos pró-invasivos desencadeadas por idade-dependente BM rigidez nas PECs (RWPE-1, BPH-1) e avaliação de metas anti-metastáticos em PTCs invasivos (PC3). Dado que BPH é considerado como sendo uma desordem metabólica 27, este protocolo também abre o caminho para a melhor compreensão da relação entre distúrbios metabólicos e aumento do risco de cancro da próstata. Dado que a BM rigidez induzida por sua exposição a produtos FGA pode ser um gatilho para a invasividade noutros cancro tipos, que será de interesse para usar o protocolo de criar modelos similares que incorporam células epiteliais normais e células tumorais de outros órgãos (por exemplo, mama, cólon, ovário, pâncreas).As etapas críticas no âmbito do protocolo, juntamente com os seus horários, estão resumidos na Figura 4. Durante o passo inicial é essencial para manter a solução estoque de RBM a 4 ° C, enquanto que derrete para evitar a sua polymerization. Pontas de pipeta não deve ser colocado na solução estoque rM até que tenham sido arrefecida a 4 ° C. Para o próximo passo, é também importante para garantir que as lâminas de câmaras foram equilibrados a 4 ° C antes de serem revestidos com a solução RBM. Assim que a temperatura da solução é aumentada RBM acima de 4 ° C, ele irá sofrer polimerização irreversível para formar um gel. É essencial que o RBM não é perturbada durante a fase de polimerização para garantir que ela forma uma superfície plana apropriada para a cultura de células e análise microscópica. A duração da incubação com GLA com ou sem inibidores da reacção de Maillard (cianoboro-hidreto de sódio e amingoguanidine) irá determinar qual a rigidez do gel torna-se RBM. Recomenda-se a utilização de uma incubação de 6 h com GLA se forem necessárias condições semi-rígidas, e 14 h de incubação, se as condições rígidas são necessárias (Tabela 1). tempos de incubação alternativo ou concentrações de GLA pode ser usado se diferentes níveisde rigidez são desejados. Neste caso análise reológica dos géis RBM precisa de ser incorporado como um passo essencial. A seguir ao passo de têmpera da reacção de Maillard, por incubação com Gee e os passos de lavagem subsequentes com PBS, os géis RBM podem ser utilizadas imediatamente ou armazenadas a 4 ° C durante até 48 h antes de seu uso para cultura de células. Uma vez que as culturas de células são configurados é importante mudar o meio de cultura (incluindo quaisquer tratamentos) a cada dois dias. Recomenda-se a manter as culturas de células 3D durante 3-12 dias de acordo com os parâmetros sob investigação. Para 3D PEC ácinos, recomenda-se analisar as culturas após 6 dias, e para a análise 3D PTC esferóides é recomendado após 3 dias de cultura na primeira instância.
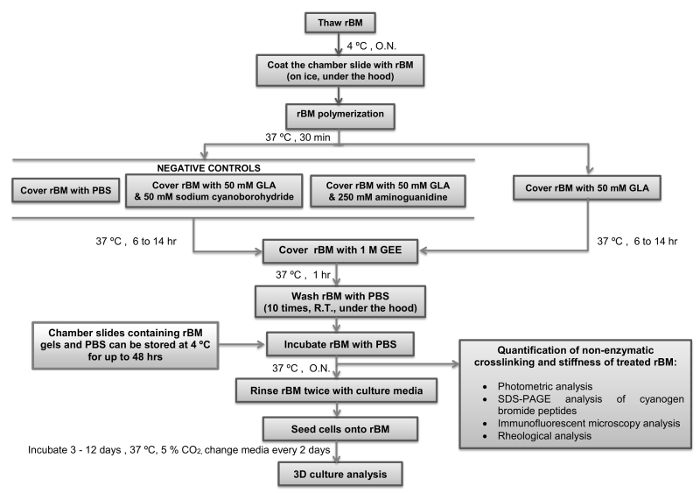
Figura 4:. Vista geral simples do protocolo com a passos críticos e sincronismos indicou a flodiagrama w descreve como preparar e endurecer a membrana basal reconstituída (RBM) com glicoaldeído (reação de Maillard) com passos críticos e horários indicados. Os pontos em que o protocolo pode ser parado, e géis RBM armazenados, são também indicados. RBM, membrana basal reconstituída; GLA, glicoaldeído; GEE, éster etílico de glicina; ON, durante a noite; PBS, solução salina tamponada com fosfato; RT, temperatura ambiente. Por favor clique aqui para ver uma versão maior desta figura.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Simon Hayward (Vanderbilt University Medical Center) for the BPH-1 cells; and Thomas Cox and Janine Erler (Biotech Research & Innovation Centre, University of Copenhagen) for their assistance with rheological measurements. MR-T was funded by Worldwide Cancer Research, formerly The Association of International Cancer Research (Grant 08-0803 to JS), The British Embassy Montevideo and Agencia Nacional de Investigacion e Innovacion (UK_RH_2015_1_2 to MR-T). MC was supported by Prostate Cancer UK (Grant S14-017 to JS and GS). KW was funded by The China Scholarship Council. MAM was funded by The Saudi Arabian Cultural Bureau.
Materials
| I – Material for monolayer culture | |||
| BPH-1 | CaP Cell Line Database | PCaCL-132 | Contact: simon.hayward@mcmail.vanderbilt.edu |
| Complete keratinocyte serum-free media | ThermoFisher Scientific | 17005-075 | Do not warm at 37 ºC before use |
| Fetal calf serum | First Link UK Ltd | 02-00-850 | Store at -20 ºC in aliquots |
| PC3 | American Type Culture Collection | CRL-1435 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15070-063 | |
| Phosphate Buffer Saline (Dulbecco A) tablets | Oxoid | BR0014G | |
| RPMI 1640 medium | Sigma-Aldrich | R5886 | warm in 37 ºC water bath before use |
| RWPE-1 | American Type Culture Collection | CRL-11609 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Name | Company | Catalog Number | Comments |
| II – Material for 3D culture | |||
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Aminoguanidine hydrochloride | Sigma-Aldrich | 396494 | Irritating to eyes, respiratory system and skin |
| Chamber slides, 8-well | Thermo Scientific Nunc Lab-Tek | TKT-210-816M | |
| Culture Matrix reconstituted basement membrane (rBM) reduced growth factor extract | AMS Biotechnology | 3445-005-01 | Store Basement membrane (BM) at -80 ºC in aliquots |
| Cyanogen bromide | Sigma-Aldrich | C91492 | Toxic by contact skin and inhalation |
| Formic acid | Sigma-Aldrich | 695076 | |
| Glycine ethyl ester hydrochloride (GEE) | Sigma-Aldrich | 50060 | Irritating to eyes |
| Glycolaldehyde dimer (GLA) | Sigma-Aldrich | G6805 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 71435 | Highly flammable; Toxic by contact skin and inhalation |
| Syringe filter 0.22 microns | Appleton Woods | BC680 | |
| Name | Company | Catalog Number | Comments |
| III – Material to quantify Maillard reaction | |||
| 4’,6-diamidino-2-phenylindole (DAPI) | ThemoFisher Scientific | D3571 | light sensitive and store at -20 ºC in aliquots |
| Cloning cylinders | Sigma-Aldrich | C1059 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11001 | light sensitive |
| Goat anti-rabbit IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11034 | light sensitive |
| Goat serum | Abcam | ab7481 | Store at -20 ºC in aliquots |
| Vectashield mounting media | Vector Laboratories | H-1000 | |
| Mouse anti-pentosidine clone PEN-12 mAb | TransGenic Inc | KH012 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | F8775 | Store at -20 ºC in aliquots |
| Rabbit anti-human collagen IV polyclonal antibody | Acris Antibodies | R1041 | Store at -20 ºC in aliquots |
| Rabbit anti-laminin A/C pAb | Santa Cruz Biotechnology Inc | sc-7292 | Store at -20 ºC in aliquots |
| Polyethylene glycol tert-octylphenyl ether (Triton-X100) | Sigma-Aldrich | T9284 | |
| Polyethylene glycol sorbitan monolaurate (Tween-20) | Sigma-Aldrich | P1379 | |
| Dialysis cassette Slide-A-Lyzer | ThemoFisher Scientific | 66333 | |
| Name | Company | Catalog Number | Comments |
| IV – Equipment | |||
| ARG2 controlled strain rotational rheometer | T.A. Instruments | ||
| Axiovert S100 (20x magnification) microscope | Zeiss | ||
| CO2 controlled humidified incubation chamber for Zeiss Axio S100 microscope | Solent Scientific | ||
| Confocal Axiovert 200M (40x, 63x magnification) microscope | Zeiss | ||
| Olympus LH50A microscope fitted with a digital camera using phase-contrast | Olympus | ||
| PHERAstar Plus plate reader spectrophotometer | BMG Labtech | ||
| Name | Company | Catalog Number | Comments |
| V – Software | |||
| Image J 1.47v | National Institute of Health, USA | ||
| MetaXpress | Molecular Divices |
References
- Timpl, R., Brown, J. C. Supramolecular assembly of basement membranes. Bioessays. 18 (2), 123-132 (1996).
- Yurchenco, P. D., Ruben, G. C. Type IV collagen lateral associations in the EHS tumor matrix. Comparison with amniotic and in vitro networks. Am J Pathol. 132 (2), 278-291 (1988).
- Halfter, W., et al. Protein composition and biomechanical properties of in vivo-derived basement membranes. Cell Adh Migr. 7 (1), 64-71 (2013).
- Candiello, J., Cole, G. J., Halfter, W. Age-dependent changes in the structure, composition and biophysical properties of a human basement membrane. Matrix Biol. 29 (5), 402-410 (2010).
- To, M., et al. Diabetes-induced morphological, biomechanical, and compositional changes in ocular basement membranes. Exp Eye Res. 116, 298-307 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Bello, D., Webber, M. M., Kleinman, H. K., Wartinger, D. D., Rhim, J. S. Androgen responsive adult human prostatic epithelial cell lines immortalized by human papillomavirus 18. Carcinogenesis. 18 (6), 1215-1223 (1997).
- Hayward, S. W., et al. Establishment and characterization of an immortalized but non-transformed human prostate epithelial cell line: BPH-1. In Vitro Cell Dev Biol Anim. 31 (1), 14-24 (1995).
- Kaighn, M. E., Narayan, K. S., Ohnuki, Y., Lechner, J. F., Jones, L. W. Establishment and characterization of a human prostatic carcinoma cell line (PC-3). Invest Urol. 17 (1), 16-23 (1979).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76 (9), 4350-4354 (1979).
- Rabilloud, T. Mechanisms of protein silver staining in polyacrylamide gels: a 10-year synthesis. Electrophoresis. 11 (10), 785-794 (1990).
- Rodriguez-Teja, M., et al. AGE-modified basement membrane cooperates with Endo180 to promote epithelial cell invasiveness and decrease prostate cancer survival. J Pathol. 235 (4), 581-592 (2015).
- Graf, B. W., Boppart, S. A. Imaging and analysis of three-dimensional cell culture models. Methods Mol Biol. 591, 211-227 (2010).
- Yao, N. Y., Larsen, R. J., Weitz, D. A. Probing nonlinear rheology with inertio-elastic oscillations. J Rheology. 52 (4), 1013-1025 (2008).
- Baker, A. M., Bird, D., Lang, G., Cox, T. R., Erler, J. T. Lysyl oxidase enzymatic function increases stiffness to drive colorectal cancer progression through FAK. Oncogene. 32 (14), 1863-1868 (2013).
- Caley, M. P., et al. Tumor-associated Endo180 requires stromal-derived LOX to promote metastatic prostate cancer cell migration on human ECM surfaces. Clin Exp Metastasis. 3 (2), 151-165 (2016).
- Sturge, J., Wienke, D., East, L., Jones, G. E., Isacke, C. M. GPI-anchored uPAR requires Endo180 for rapid directional sensing during chemotaxis. J Cell Biol. 162 (5), 789-794 (2003).
- Sturge, J., Wienke, D., Isacke, C. M. Endosomes generate localized Rho-ROCK-MLC2-based contractile signals via Endo180 to promote adhesion disassembly. J Cell Biol. 175 (2), 337-347 (2006).
- Rodriguez-Teja, M., et al. Survival Outcome and EMT Suppression Mediated by a Lectin Domain Interaction of Endo180 and CD147. Mol Cancer Res. 13 (3), 538-547 (2015).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139 (5), 891-906 (2009).
- Carson, W. C., et al. Material characterization of ex vivo prostate tissue via spherical indentation in the clinic. Med Eng Phys. 33 (3), 302-309 (2011).
- Hoyt, K., et al. Tissue elasticity properties as biomarkers for prostate cancer. Cancer Biomark. 4 (4-5), 213-225 (2008).
- Krouskop, T. A., Wheeler, T. M., Kallel, F., Garra, B. S., Hall, T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 20 (4), 260-274 (1998).
- Zhang, M., et al. Quantitative characterization of viscoelastic properties of human prostate correlated with histology. Ultrasound Med Biol. 34 (7), 1033-1042 (2008).
- Corona, G., et al. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol. , (2014).

