纳米传感器检测体内蛋白酶活性的无创诊断
Summary
蛋白酶是严格调控的酶参与基本的生物学过程, 失调蛋白酶活动推动复杂疾病, 如癌症的进展。该方法的目的是创造纳米传感器, 以测量体内蛋白酶的活动, 产生一个可从宿主尿和歧视性疾病检测到的裂解信号。
Abstract
蛋白酶是多功能酶, 专门研究肽键的水解和控制广泛的生物过程, 包括稳态和 allostasis。此外, 失调蛋白酶活性驱动发病机制, 是疾病的功能性生物标志物, 如癌症;因此, 检测体内蛋白酶活性的能力可以为生物医学诊断提供临床相关信息。该协议的目的是创造纳米传感器, 通过产生一个可量化的尿液信号, 探索体内蛋白酶的活性。这些蛋白酶纳米传感器由两个成分组成: 纳米粒子和基体。纳米微粒的作用是增加循环半衰期和基质输送到目标疾病地点。基板是一个短肽序列 (6-8 AA), 这是专门针对目标蛋白酶或一组蛋白酶。基体与纳米微粒的表面共轭, 并由记者 (如荧光标记) 终止, 用于检测。当失调蛋白酶切割肽基板时, 记者被过滤成尿液, 作为蛋白酶活性的生物标志物。本文描述了基质金属蛋白酶 9 (MMP9) nanosensor 的构建, 它与肿瘤的进展和转移有关, 用于在小鼠模型中检测大肠癌。
Introduction
蛋白酶是多功能酶, 专门研究肽键的水解, 对许多生物过程有显著的控制作用, 包括稳态、allostasis 和疾病1。蛋白酶活性的改变状态与各种疾病相关, 包括癌症和心血管疾病, 使蛋白酶有吸引力的候选者发展成为临床生物标志物2,3。此外, 蛋白酶活性在功能上与不同的梗死再发, 患者的结局和疾病的预后4。广泛地, 生物传感器被开发用于检测各种生物学现象和疾病, 如癌症, 神经退行性疾病, 电子转移过程5,6,7,8,9. 更具体地说, 以基板为基础的蛋白酶传感器用于检测蛋白酶活性, 包括荧光探针, 用于诊断成像10和 isotopically 标记的肽基片体外质谱检测11。此外, 还开发了基于活动的探针, 其中含有与基片类似的区域, 可以约束或修改目标蛋白酶12。采用这种方法, 当活性部位改变时, 目标蛋白酶不可逆转地受到抑制, 分析需要组织的收获, 这限制了体内的应用。然而,在体内对蛋白酶活性的感知是很重要的, 因为对蛋白酶活性的调节严重依赖于其他生物活动的上下文, 如内源性抑制剂的存在。
这项工作的目的是描述以活动为基础的纳米传感器的配方, 通过产生一个可测量的尿液来检测体内蛋白酶的活性。这个平台被用来作为一种无创诊断, 以鉴别复杂的疾病, 如癌症, 使用失调蛋白酶活动作为功能生物标志物。我们的 nanosensor 平台由氧化铁纳米粒子 (IONP) 与蛋白酶基体结合而成。这些基底被一个荧光记者终止, 当蛋白酶切割基体时释放。这些 IONPs在体内循环, 定位到疾病部位, 并暴露基质到活性疾病相关的蛋白酶。乳沟后, 荧光记者被释放, 由于其体积小, 被过滤成尿液, 而 uncleaved 基质上的 IONP 留在体内。因此,体内蛋白酶活性的增加会导致尿液中的记者浓度增高 (图 1)。由于我们的平台是尿液测试, 不需要成像平台和诊断信号丰富的尿液。
这个平台可以被设计来检测各种疾病, 包括癌症, 纤维化, 血栓形成13,14。在这里, 我们描述了纳米传感器的设计, 以检测基质 metallopeptidase 9 (MMP9) 活性作为结直肠癌的生物标志物的海拔。大肠癌是美国癌症死亡的第二大原因, 估计仅在2014年就有136800例新病例和50300人死亡.结直肠肿瘤细胞产生 MMP9, 这已经显示出推动恶性进展, 基质退化, 以及转移16。此外, 我们确定了一个合适的肽基质 (PLGVRGK) 为 MMP9 从文献17。该平台可用于早期癌症检测和低成本的护理点诊断13,14,18,19,20,21。
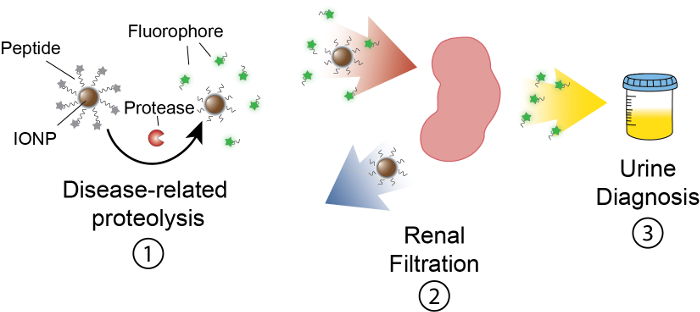
图 1:体内Nanosensor 活动示意图.纳米传感器循环通过身体和本地化到疾病的地点。然后, IONPs 提出了与疾病相关的蛋白酶劈裂肽基。切割碎片的大小允许肾脏清除, 导致他们在尿中定位。在动物小便后, 这些肽片段可以通过他们的记者分子来分析。请单击此处查看此图的较大版本.
Protocol
Representative Results
Discussion
该方法描述了由共轭纳米粒核的蛋白酶基质组成的活性纳米传感器的发展。蛋白水解的事件被称为 “药代动力学开关”, 因为裂解肽产品小于肾脏大小的过滤限制5毫微米23和过滤成尿产生无创信号。因此, 重要的是使用纳米粒子或载体的水动力半径大于 5 nm, 因为任何更小的将被肾脏迅速清除和混淆尿信号。我们使用 pegylated IONPs, 因为他们是 FDA 批准, 耐受性好, 并有循环半衰期 3-5 小…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作由 NIH 主任的新创新奖 (奖号) 资助。DP2HD091793)。Q.D.M. 得到 NSF 研究生研究奖学金计划的支持 (批准号:DGE-1650044)。H 获得美国国立卫生研究院 GT BioMAT 训练补助金的支持, 5T32EB006343 和格鲁吉亚技术总裁的奖学金。G.A.K. 在 “宝来欢迎基金” 的科学界面上担任职业奖。内容完全是作者的责任, 不一定代表国家卫生研究院的官方意见。
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

