Наносенсоры обнаружить протеазы активность In Vivo для неинвазивной диагностики
Summary
Протеаз являются жестко регулируемых ферментов, участвующих в основных биологических процессов и dysregulated протеазы активности дисков прогрессирование таких сложных заболеваний, как рак. Цель этого метода заключается в создании Наносенсоры, измерить протеазы активность в естественных условиях , производя расщепления сигнал, который выявляется от принимающей мочи и дискриминирует болезни.
Abstract
Многофункциональный ферменты, которые специализируются в гидролиза пептидных связей и управления широкие биологические процессы, включая гомеостаза и аллостазии протеаз. Кроме того dysregulated протеазы активность диски патогенеза и функциональной биомаркеров таких заболеваний, как рак; Таким образом способность обнаруживать протеазы активность в естественных условиях может обеспечить клинически соответствующую информацию для биомедицинской диагностики. Целью настоящего Протокола является создание Наносенсоры, что зонд для протеазы деятельность в естественных условиях , производя сигнал количественно в моче. Эти протеазы Наносенсоры состоят из двух компонентов: наночастиц и субстрата. Наночастицы функций увеличить тираж half-life и субстрат доставки целевых болезней сайтов. Подложка является последовательность коротких пептида (6-8 АА), который предназначен для определенного целевого протеазы или группе протеаз. Субстрат конъюгированных на поверхности наночастиц и прекращается по репортер, например флуоресцентного маркера, для обнаружения. Как dysregulated протеазами расщеплять пептид субстрата, репортер фильтруется в мочи для количественной оценки в качестве биомаркера активности протеаз. Здесь мы описываем строительство нано для матрицы металлопротеиназы 9 (MMP9), который связан с прогрессии опухоли и метастазов, для выявления колоректального рака в мышиной модели.
Introduction
Протеаз являются многофункциональный ферменты, которые специализируются в гидролиза пептидных связей и имеют значительный контроль над много биологических процессов, включая гомеостаза, аллостазии и болезни1. Измененное состояние активности протеаз было увязать для различных заболеваний, включая рак и сердечно-сосудистые заболевания, что делает привлекательным протеаз кандидатов для развития клинических биомаркеров2,3. Кроме того протеазы деятельность является функционально связан с собственный патогенезы, исходы и прогноз заболевания4. Широко обнаружить различные биологические явления были разработаны Биосенсоры и заболеваний, как рак, нейродегенеративные заболевания и перенос электрона обрабатывает5,6,,78 , 9. Говоря более конкретно, на основе субстрат протеазы датчики разработаны для выявления активности протеаз и включают в себя fluorogenic зонды для диагностических изображений10 и гетерогенны помечены пептидных субстратов для в пробирке Обнаружение массового спектрометрирования11. Кроме того были разработаны на основе активности зондами, которые содержат субстрата как регионы, которые связывают или изменить целевой протеазы12. С помощью этого метода протеазы целевой необратимо ингибируется, когда изменяется на активном узле, и анализ требует уборки из ткани, которая ограничивает в vivo приложений. Однако важно чувство протеазы активность в естественных условиях, потому что регулирование деятельности протеазы сильно зависит от контекста других биологической деятельности, таких как наличие эндогенных ингибиторов.
Целью этой работы является описание разработки на основе деятельности Наносенсоры, что обнаружить протеазы активность в естественных условиях , производя измеримые сигнал в моче. Эта платформа используется как неинвазивный диагностический различать сложных заболеваний, как рак, используя dysregulated протеазы деятельность как функциональный биомаркеров. Наша платформа нано состоит наночастиц оксида железа (IONP), конъюгированных протеазы субстратов. Эти субстраты завершенны флуоресцентные репортер, который высвобождается, когда протеаз прилепится субстрата. Эти IONPs циркулируют в vivo, локализации болезни сайтов и разоблачить субстратов для активной болезни связанные протеаз. После расщепления флуоресцентный Репортеры выпускаются и, из-за их малого размера, фильтруются в моче, в то время как uncleaved субстратов на IONP остаются в организме. Таким образом увеличение протеазы мероприятия в естественных условиях приведет к повышению концентрации репортер в моче (рис. 1). Поскольку наша платформа является тест мочи, не платформа отображения информации является обязательным и диагностические сигналы обогащаются в моче.
Эта платформа могут быть спроектированы для обнаружения различных заболеваний, включая рак, фиброза и тромбоз13,14. Здесь мы описываем дизайн Наносенсоры обнаружить фасады в матрице metallopeptidase 9 (MMP9) деятельность как биомаркер рака прямой кишки. Колоректальный рак является второй ведущей причиной смерти от рака в Соединенных Штатах, с приблизительно 136,800 новых случаев и 50,300 смертей в 2014 только15. Колоректальные опухоли клетки производят MMP9, который был показан диск злокачественные прогрессии, матрица деградации, а также метастазов16. Кроме того мы определили подложке подходящий пептида (PLGVRGK) для MMP9 из литературы17. Эта платформа может использоваться для раннего обнаружения рака и низкой стоимости обслуживания точки диагностики13,14,18,19,,2021.
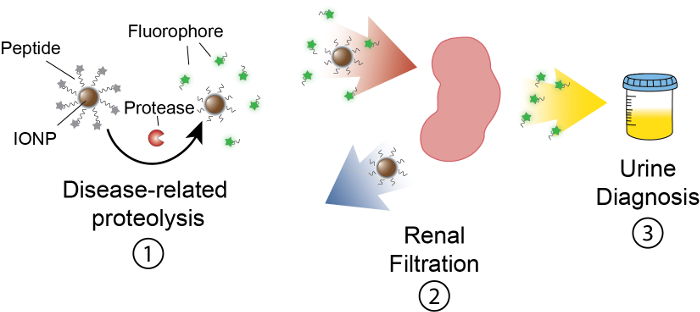
Рисунок 1: Схема активности нано в vivo. Наносенсоры циркулируют через тело и локализации сайтов заболеваний. Затем связанные с болезнью протеаз прилепится пептидных субстратов, представленный IONPs. Размер рассеченного фрагментов позволяет почечного клиренса, заставляя их локализовать в моче. После того, как животное мочится, эти терпеноидные фрагменты могут быть проанализированы их молекулы репортер. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Этот метод описывает развитие деятельности на основе Наносенсоры, состоящий из протеазы субстратов, конъюгированных наночастиц ядро. Событие протеолитического расщепления называют «фармакокинетические переключатель», потому что рассеченного пептидных продуктов меньше, чем почечн?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа финансировалась NIH директор новой новатор Award (премия No. DP2HD091793). Q.D.M. поддерживается выпускников стипендии программы исследований NSF (Грант № DGE-1650044). B.A.H поддерживается национальных институтов из здравоохранения GT BioMAT обучения Грант под награду номер 5T32EB006343, а также стипендий Президента Грузии Tech. G.A.K. проводит Career Award в интерфейсе научного фонда Добро Берроуз. Содержание является исключительно ответственности авторов и не обязательно отражают официальную точку зрения национальных институтов здоровья.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

