Nanosensors om te detecteren Protease activiteit In Vivo Noninvasive Diagnostics
Summary
Proteasen zijn strak gereguleerde enzymen die betrokken zijn bij de fundamentele biologische processen en dysregulated protease-activiteit stations progressie van complexe ziekten zoals kanker. Doel van deze methode is het creëren van nanosensors die door het produceren van een decollete-signaal dat is aantoonbaar uit host urine en discrimineert ziekte protease activiteit in vivo meten.
Abstract
Proteasen zijn multifunctionele enzymen die zijn gespecialiseerd in de hydrolyse van peptide-obligaties en brede biologische processen, met inbegrip van homeostase en allostasis te controleren. Bovendien dysregulated protease-activiteit drijft pathogenese en is een functionele biomarker van ziekten zoals kanker; Daarom kan de mogelijkheid om te detecteren protease activiteit in vivo klinisch relevante informatie voor biomedische diagnostische gegevens bevatten. Het doel van dit protocol is het creëren van nanosensors die voor protease activiteit in vivo sonde door overlegging van een meetbare signaal in de urine. Deze protease-nanosensors bestaan uit twee onderdelen: een nanoparticle en substraat. De functies van de nanoparticle te verhogen omloop half-life en substraat levering naar doel ziekte sites. Het substraat is een opeenvolging van korte peptide (6-8 AA), die is ontworpen om specifiek voor een doelgroep protease of de protease-groep. Het substraat is geconjugeerd met het oppervlak van de nanoparticle en wordt beëindigd door een verslaggever, zoals een TL marker, voor de detectie. Zoals dysregulated proteasen het peptide substraat klieven, wordt de verslaggever gefilterd in de urine voor kwantificering als een biomarker van protease-activiteit. Hierin beschrijven we de bouw van een nanosensor voor matrix metalloproteinase 9 (MMP9), die geassocieerd met tumor progressie en metastase, voor de opsporing van colorectale kanker in een muismodel wordt.
Introduction
Proteasen zijn multifunctionele enzymen die zijn gespecialiseerd in de hydrolyse van peptide-obligaties en aanzienlijke controle hebben over vele biologische processen, met inbegrip van homeostase, allostasis en ziekte1. Een veranderde staat van protease-activiteit heeft zijn gecorreleerd aan een verscheidenheid van ziekten, waaronder kanker en hart-en vaatziekten, proteasen aantrekkelijke kandidaten voor ontwikkeling in klinische biomarkers2,3te maken. Protease-activiteit is bovendien functioneel gekoppeld aan verschillende pathogeneses, patiëntenoutcomes en prognose van de ziekte4. In het algemeen, biosensoren zijn ontwikkeld voor het detecteren van diverse biologische fenomenen en ziekten, zoals kanker, neurodegeneratieve ziekte en elektron overdracht verwerkt5,6,7,8 , 9. meer in het bijzonder, substraat-gebaseerde protease sensoren zijn ontwikkeld voor het opsporen van protease-activiteit, en omvatten fluorogenic sondes voor diagnostische imaging10 en ionenpaar met het label peptide substraten voor in vitro detectie door massaspectrometrie11. Bovendien, zijn activity based sondes ontwikkeld, waarin substraat-achtige gebieden die binden of wijzigen van de target protease12. Met deze methode wordt de doel-protease onherroepelijk geremd wanneer de actieve site wordt gewijzigd, en analyse vereist oogsten van weefsel, waardoor in vivo toepassingen wordt beperkt. Het is echter belangrijk te voelen protease activiteit in vivo, omdat de verordening van protease-activiteit is sterk afhankelijk van de context van andere biologische activiteiten zoals de aanwezigheid van endogene remmers.
Het doel van dit werk is voor het beschrijven van de formulering van activity based nanosensors die protease activiteit in vivo detecteren met het produceren van een meetbare signaal in de urine. Dit platform wordt gebruikt als een noninvasive diagnose te discrimineren complexe ziekten zoals kanker met behulp van dysregulated protease-activiteit als een functionele biomarker. Ons nanosensor platform bestaat uit ijzeroxide nanodeeltjes (IONP), geconjugeerd met protease substraten. Deze substraten worden beëindigd door een fluorescerende verslaggever die wordt vrijgegeven wanneer proteasen het substraat klieven. Deze IONPs circuleren in vivolokaliseren naar ziekte sites en substraten voor actieve ziekte-geassocieerde proteasen bloot. Na decollete, fluorescerende verslaggevers worden vrijgegeven en, als gevolg van hun geringe omvang, worden gefilterd in de urine, terwijl uncleaved substraten op de IONP in het lichaam blijven. Daarom zal een toename van protease activiteiten in vivo resulteren in hogere concentraties van verslaggever in urine (Figuur 1). Aangezien ons platform een urinetest is, geen imaging platform is vereist en diagnosesignalen zijn verrijkt met urine.
Dit platform kan worden ontworpen om te ontdekken een scala van ziekten zoals kanker, fibrose en trombose13,14. Hier beschrijven we het ontwerp van nanosensors te detecteren waterstand in de Matrix metallopeptidase 9 (MMP9) activiteit als een biomarker van colorectal kanker. Darmkanker is de tweede belangrijke doodsoorzaak kanker in de Verenigde Staten, met een geschatte 136,800 nieuwe gevallen en sterfgevallen van de 50,300 in 2014 alleen al15. Colorectale tumorcellen produceren MMP9, die heeft aangetoond dat de schijf kwaadaardige progressie, aantasting van de matrix, evenals metastase16. Bovendien, we geïdentificeerd een geschikt peptide substraat (PLGVRGK) voor MMP9 van de literatuur17. Dit platform kan worden gebruikt voor de vroegtijdige opsporing van kanker en goedkope point-of-care diagnostiek13,14,18,19,20,21.
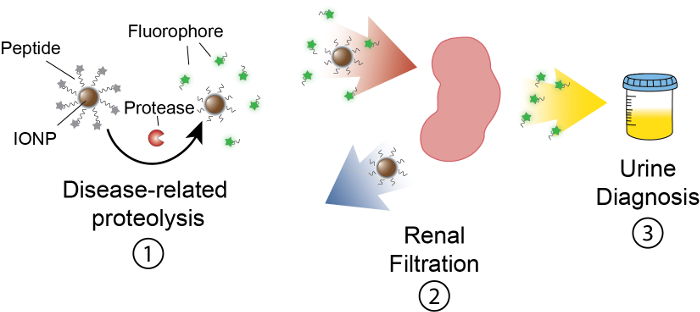
Figuur 1: schematische van Nanosensor activiteit In vivo. Nanosensors door het lichaam circuleren en lokaliseren naar sites van ziekte. Vervolgens, klieven proteasen ziekte-gerelateerde peptide substraten gepresenteerd door IONPs. De grootte van gekloofd fragmenten voorziet in renal clearance, waardoor ze te lokaliseren in de urine. Nadat het dier plast, kunnen deze peptide fragmenten worden geanalyseerd door hun verslaggever molecule. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
Deze methode beschrijft de ontwikkeling van activity based nanosensors bestaande uit protease substraten geconjugeerd met een kern van nanoparticle. De gebeurtenis van Proteolytische decolleté is dubbed the “farmacokinetische switch”, omdat gekloofd peptide producten kleiner dan de maximale filtratie renale grootte van 5 nm23 en filter in de urine zijn te produceren een noninvasive signaal. Daarom is het belangrijk om te gebruiken van nanodeeltjes of dragers met een hydrodynamische straal die gro…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd gefinancierd door van de directeur van een NIH New Innovator Award (Award nr. DP2HD091793). Q.D.M. wordt ondersteund door de NSF Graduate Research Fellowships Program (Grant nr. DGE-1650044). B.A.H wordt ondersteund door de nationale instituten van gezondheid GT BioMAT Training subsidie onder Award nummer 5T32EB006343, evenals de Georgia Tech President’s Fellowship. G.A.K. houdt een Career Award aan de wetenschappelijke Interface uit de Burroughs Welcome Fonds. De inhoud is uitsluitend de verantwoordelijkheid van de auteurs en vertegenwoordigt niet noodzakelijk de officiële standpunten van de National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

