Misurazione del potenziale d'azione ottico a singola cellula in cardiomiociti derivati da cellule staminali pluripotenti indotte umane
Summary
Qui descriviamo l’acquisizione ottica e la caratterizzazione di potenziali d’azione da cardiomiociti derivati da cellule staminali pluripotenti indotte utilizzando un sistema di fotometria modulare ad alta velocità.
Abstract
Le tecniche convenzionali di microelettrodi intracellulari per quantificare l’elettrofisiologia dei cardiomiociti sono estremamente complesse, ad alta intensità di lavoro e tipicamente eseguite a bassa produttività. La rapida e continua espansione della tecnologia delle cellule staminali pluripotenti indotte (iPSC) presenta un nuovo standard nella ricerca cardiovascolare e sono ora necessari metodi alternativi per aumentare la produttività dei dati elettrofisiologici a livello di singola cellula. VF2.1Cl è un colorante sensibile alla tensione di recente derivazione che fornisce una rapida risposta a canale singolo e di alta grandezza alle fluttuazioni del potenziale di membrana. Possiede una cinetica superiore a quella di altri indicatori di tensione esistenti e rende disponibili dati funzionali equivalenti a quelli delle tecniche tradizionali di microelettrodo. Qui, dimostriamo la caratterizzazione semplificata e non invasiva del potenziale d’azione nei cardiomiociti umani derivati da iPSC a ritmo esterno utilizzando un sistema di fotometria modulare e altamente conveniente.
Introduction
La modellazione elettrofisiologica dei cardiomiociti e la costruzione di piattaforme efficienti per lo screening dei farmaci cardiaci è essenziale per lo sviluppo di strategie terapeutiche per una varietà di disturbi aritmici. La rapida espansione della tecnologia delle cellule staminali pluripotenti indotte (iPSC) ha prodotto promettenti incursioni nella modellizzazione delle malattie umane e nell’indagine farmacologica utilizzando cardiomiociti derivati da pazienti isolati (iPSC-CM). Le tecniche “Gold standard” per la caratterizzazione elettrofisiologica di queste cellule attraverso patch-clamp (current-clamp) possono quantificare la morfologia e la durata del potenziale d’azione (AP), tuttavia, questo metodo è incredibilmente complesso e lento e non adatto per l’acquisizione di dati ad alto rendimento1. IPSC-CM sono regolarmente segnalati per avere un aumento del potenziale di membrana diastolica e una maggiore corrente di dispersione rispetto ai cardiomiociti nativi adulti2. Si suggerisce che le dimensioni più piccole delle cellule e la ridotta capacità della membrana osservata nelle iPSC-CM possano produrre qualche errore sistematico quando si utilizza la tecnica del morsetto di corrente, forse spiegando queste deviazioni3. Al fine di massimizzare l’utilità di una piattaforma iPSC-CM, un metodo aggiuntivo è prezioso per aumentare la produttività e garantire l’accuratezza dei dati quando si caratterizzano le variazioni di tensione transmembrana a livello di singola cella in iPSC-CM.
I coloranti sensibili alla tensione (VSD) sono stati a lungo un metodo proposto per fornire un’analisi più rapida, non invasiva ed equivalente della cinetica AP cardiaca rispetto a quelle delle tecniche tradizionali4. Un recente studio ha dimostrato l’idoneità della fotometria della sonda sensibile alla tensione di tensione per quantificare con precisione l’AP5 cardiaco. Inoltre, la capacità di scalare prontamente gli approcci di fotometria ottica conferisce questa tecnica a schermi cardiotossicità su larga scala critici nello sviluppo di farmaci terapeutici (ad esempio, CiPA). Lo sviluppo di protocolli di cardiotossicità standardizzati in uno studio multi-sito in cieco utilizzando array di microelettrodi e tecniche ottiche di rilevamento della tensione ha dimostrato il valore chiave di questo approccio6.
Molti coloranti potenziometrici sono disponibili in commercio e lo sviluppo sintetico in corso di nuove sonde mostra un potenziale entusiasmante per semplificare la loro efficacia in una varietà di costrutti cardiaci e neurali. Il VSD ideale avrà una cinetica e una sensibilità aumentate, mentre mostra una diminuzione del carico capacitivo, del fotoscissicità e della citotossicità. Il VF2.1Cl (FluoVolt) recentemente sintetizzato esprime molte di queste proprietà benefiche in gran parte grazie alla sua nuova struttura molecolare a filo, condivisa da altri membri della nuova famiglia VoltageFluor (VF)7. In contrasto con i comuni VSD elettrocromici in cui semplici sonde si coniugano molecolarmente ed elettricamente alla membrana plasmatica, questo colorante è costituito da un filo sintetico inserito passivamente, che abbraccia la membrana che accoppia un donatore ricco di elettroni con un fluoroforo di fluoresceina modificato (FITC). I dettagli meccanicistici sono forniti nella Figura 1. Questo colorante dimostra un’eccellente sensibilità alle fluttuazioni di tensione della membrana, mostrando una variazione del 27% dell’intensità di emissione per 100 mV rispetto a ~ 10% osservata in altre sonde comuni a velocità comparabili7. Inoltre, i sistemi PeT a filo non interagiscono direttamente con il campo elettrico cellulare che produce interferenze elettriche minime e cambiamenti trascurabili nel carico capacitivo cellulare.
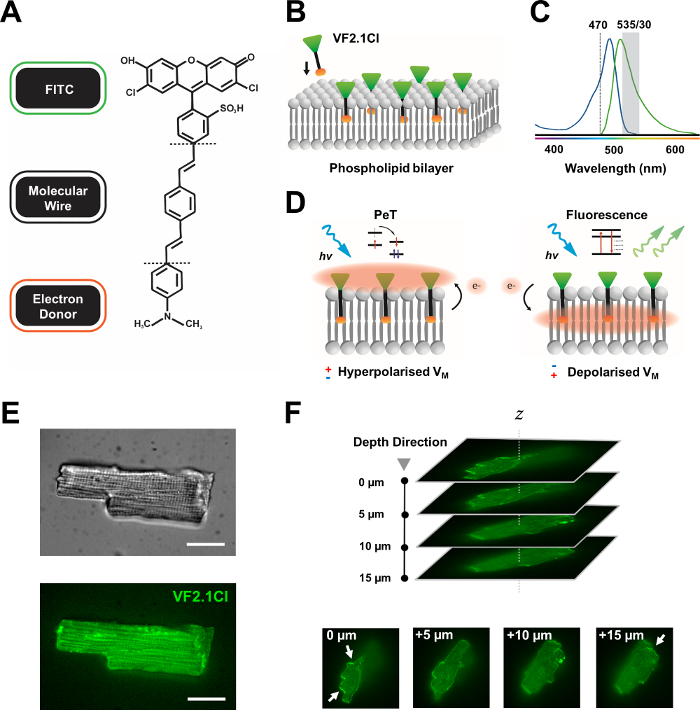
Figura 1: Parametri chimici, spettrali e meccanicistici del colorante VF2.1Cl. (A) Struttura chimica di VF2.1Cl. Le caratteristiche molecolari da notare includono più gruppi alchilici all’interno del filo molecolare fenilene vinilene che facilitano l’inserimento nella membrana plasmatica. Un gruppo di acido solfonico caricato negativamente coniugato alla sonda FITC assicura la stabilizzazione del fluoroforo sulla superficie extracellulare e aiuta vicino all’inserzione perpendicolare rispetto al campo elettrico del doppio strato lipidico. (B) Schema semplificato dell’incorporazione perpendicolare di VF2.1Cl nella membrana plasmatica di una cellula bersaglio. (C) Spettri di assorbimento ed emissione del colorante VF2.1Cl. Gli spettri sono identici a quello delle sonde FITC e GFP standard. (D) Rappresentazione del meccanismo d’azione di VF2.1Cl. In condizioni di riposo (iperpolarizzato), tensioni intracellulari negative guidano gli elettroni liberi verso il fluoroforo rostrale. L’abbondanza di elettroni assicura che il trasferimento di elettroni fotoindotto (PeT) sia favorito come via d’uscita dallo stato eccitato dopo l’eccitazione ottica, spegnendo efficacemente la fluorescenza. Al contrario, un potenziale di membrana depolarizzato influenza il movimento verso il basso degli elettroni favorendo la fluorescenza all’eccitazione ottica. La risposta fluorescente risultante è linearmente correlata alla tensione di membrana e può essere utilizzata con precisione per raccogliere informazioni temporali dettagliate sulla cinetica elettrofisiologica cellulare. (E) Immagini rappresentative a campo luminoso (superiore) e fluorescenza a 470 nm (inferiore) di cardiomiociti leporina caricati con pila VF2.1Cl. (F) Z di un singolo cardiomiocita caricato. Le frecce indicano aree di chiara localizzazione di VF2.1Cl alla membrana cellulare. Le immagini sono state acquisite con un sistema confocale a disco rotante costituito da una testa confocale a disco rotante X-lightv3 con un modello stenopeico da 50 μm; Illuminatore LDI-7; Fotocamera Prime95B e obiettivo PlanApo Lambda 100x. Barra della scala: 20 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
La sonda FITC coniugata a VF2.1Cl assicura che possa essere utilizzata efficacemente nelle configurazioni standard e dei filtri GFP e richiede solo un sistema di acquisizione a canale singolo, entrambe caratteristiche comuni delle piattaforme di imaging fluorescenti. Analisi di monostrati iPSC-CM umani densi con questo colorante è stata recentemente riportata8,9,10,11. Il nostro protocollo differisce da questi studi a causa della nostra indagine su singoli iPSC-CM isolati, imperturbabili dalle influenze elettriche e paracrine di densi monostrati sinciziali e dal nostro uso di un sistema di fotometria economico e personalizzabile rispetto a complesse disposizioni di imaging confocale o ad ampio campo.
Qui, descriviamo il nostro protocollo per l’acquisizione rapida e l’analisi di robusti AP ottici da cardiomiociti umani isolati derivati da iPSC e cardiomiociti nativi (vedi File supplementare). Utilizziamo VF2.1Cl abbinato a una piattaforma all’avanguardia personalizzabile per misure fotometriche a cella singola. Questi protocolli sperimentali sono stati approvati dal comitato etico del Centro medico universitario di Gottinga (n. 10/9/15).
Protocol
Representative Results
Discussion
Qui descriviamo un protocollo di base per acquisire facilmente profili AP dettagliati da iPSC-CM isolati adatti per la modellazione elettrofisiologica e lo screening di farmaci cardiaci. Rileviamo AP regolari e robusti dai nostri iPSC-CM scarsamente seminati, il che suggerisce sia la funzionalità dell’indicatore che la fedeltà metodologica.
A causa dell’ampio spettro di metodologie commerciali per la riprogrammazione iPSC e della mancanza di standardizzazione per i protocolli di differenziaz…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare Cairn Research Ltd. per il loro gentile contributo finanziario che ha coperto i costi di produzione di questa pubblicazione. Inoltre, ringraziamo la signora Ines Mueller e la signora Stefanie Kestel per il loro eccellente supporto tecnico.
La ricerca degli autori è sostenuta dal Centro tedesco per la ricerca cardiovascolare (DZHK), dalla Deutsche Forschungsgemeinschaft (DFG, Fondazione tedesca per la ricerca, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 e nell’ambito della strategia di eccellenza della Germania – EXC 2067/1- 390729940) e dalla Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
References
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. 생화학. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

