Induction de microflux par des oscillations de bulles non sphériques dans un système de lévitation acoustique
Summary
Une technique rapide et fiable est proposée pour contrôler les oscillations de forme d’une seule bulle acoustique piégée basée sur la technique de coalescence entre deux bulles. Les oscillations de forme de bulle à l’état stationnaire, contrôlées par symétrie, permettent d’analyser l’écoulement du fluide généré au voisinage de l’interface de bulle.
Abstract
Lorsqu’elles sont situées près de barrières biologiques, les microbulles oscillantes peuvent augmenter la perméabilité de la membrane cellulaire, permettant l’internalisation des médicaments et des gènes. Les observations expérimentales suggèrent que la perméabilisation temporaire de ces barrières peut être due à la contrainte de cisaillement exercée sur les tissus cellulaires par la microdiffusion en cavitation. Le microstreaming de cavitation est la génération de flux de vortex qui se produisent autour de microbulles d’ultrasons oscillantes. Pour produire de tels écoulements liquides, les oscillations à bulles doivent s’écarter des oscillations purement sphériques et inclure soit une instabilité translationnelle, soit des modes de forme. Les études expérimentales des écoulements induits par les bulles et des contraintes de cisaillement sur les surfaces voisines ont souvent une portée limitée en raison de la difficulté de capturer les déformations de forme des microbulles de manière stable et contrôlable. Nous décrivons la conception d’une chambre de lévitation acoustique pour l’étude des oscillations non sphériques contrôlées par symétrie. Un tel contrôle est effectué en utilisant une technique de coalescence entre deux bulles approchantes dans un champ ultrasonore suffisamment intense. Le contrôle des oscillations non sphériques ouvre la voie à un microflux de cavitation contrôlée d’une microbulle libre oscillant en surface. Les caméras à fréquence d’images élevée permettent d’étudier presque simultanément la dynamique des bulles non sphériques à l’échelle de temps acoustique et l’écoulement du liquide à une échelle de temps inférieure. Il est montré qu’une grande variété de motifs de fluide peut être obtenue et qu’ils sont corrélés au contenu modal de l’interface à bulles. Nous démontrons que même les modes de forme d’ordre élevé peuvent créer des motifs fluides à grande distance si la dynamique de l’interface contient plusieurs modes, soulignant le potentiel des oscillations non sphériques pour l’administration ciblée et localisée de médicaments.
Introduction
En médecine, un médicament administré doit franchir de nombreux obstacles dans le système vivant avant d’atteindre les cibles souhaitées. Cependant, la plupart des médicaments sont rapidement nettoyés de la circulation sanguine. L’efficacité du ciblage est faible et ils ne peuvent pas facilement traverser les membranes cellulaires, ce qui entraîne une administration inefficace des médicaments. Actuellement, l’utilisation de microbulles en combinaison avec les ultrasons a été proposée comme une méthode innovante pour l’administration non invasive, précise et ciblée de médicaments et de gènes aux tissus et cellules pathologiques1. Dans cette approche, les microbulles peuvent jouer un rôle de support lorsque les médicaments libres sont soit co-injectés avec une suspension de bulles de gaz, soit chargés à sa surface. Les microbulles peuvent également agir comme un vecteur local pour recentrer l’énergie ultrasonore afin d’interagir avec les cellules. Fondamentalement, sous exposition aux ultrasons, les bulles se compriment et se dilatent de manière stable, un régime appelé cavitation stable qui génère des écoulements liquides et donc une contrainte de cisaillement sur les objets proches. Les microbulles peuvent également osciller de manière non linéaire et se dilater jusqu’à l’effondrement, dans le régime de cavitation inertielle, produisant des ondes de choc qui se propagent radialement à partir du site d’effondrement2. Il a été démontré que la cavitation, stable ou inertielle, améliore la perméabilisation des membranes cellulaires, et améliore ainsi l’internalisation des médicaments dans la cellule3.
Dans les applications thérapeutiques, la compréhension du mécanisme de l’interaction bulle-cellule est très importante, mais il existe plusieurs obstacles, tant du point de vue scientifique que technique, qui empêchent nos connaissances de progresser. Premièrement, capturer la dynamique des cellules en réponse à des stimuli mécaniques induits par des bulles est très difficile4. À l’échelle de temps acoustique, les oscillations de microbulles de premier ordre peuvent conduire à l’activation des canaux membranaires, facilitant le passage moléculaire à travers les interfaces biologiques. Cela se produit par l’oscillation directe de la membrane cellulaire, également appelée « massage cellulaire »5. L’activation des canaux à la suite d’un stress mécanique direct a été mise en évidence à l’aide de techniques de pince patch-clamp qui mesuraient les propriétés électrophysiologiques des membranes cellulaires pendant et après l’exposition aux ultrasons6. La mesure de la dynamique cellulaire induite par les bulles (c’est-à-dire le champ complet de déformation de la membrane cellulaire) à l’échelle de temps acoustique permettrait également de mieux comprendre le seuil d’expansion de la zone membranaire Δ A/A nécessaire pour induire les pores dans la membrane cellulaire7. La deuxième barrière consiste à contrôler le régime d’effondrement des bulles pour éviter la lyse cellulaire induite par les microbulles. Les effondrements de bulles et les microjets induits ont été identifiés comme un mécanisme par lequel la perforation de la membrane se produit 8,9. Une fois perméabilisée, la membrane cellulaire se répare par auto-obturation calcique des bicouches lipidiques et fusion des vésicules intracellulaires9. L’apparition d’effondrements de bulles peut également causer des dommages mortels à la cellule et induire des effets secondaires inutiles dans les environs. Dans les applications sensibles telles que l’ouverture de la barrière hémato-encéphalique médiée par les ultrasons, il est généralement admis que les effondrements de bulles inertielles doivent être évités10.
Par conséquent, d’énormes efforts sont actuellement consacrés à la conception de séquences d’émission d’ultrasons, couplées à la surveillance et au contrôle passifs de la cavitation, afin d’assurer des oscillations stables des microbulles11. Dans ce régime stable, on a émis l’hypothèse que les bulles oscillantes de manière stable jouent un rôle important dans le déclenchement de la perméabilisation membranaire en favorisant une contrainte de cisaillement spatialement ciblée sur la membrane cellulaire7. La contrainte de cisaillement résulte des écoulements de liquide créés au voisinage des bulles oscillantes. Ces flux liquides sont appelés microflux de cavitation et, comme mentionné ci-dessus, ils sont l’un des nombreux mécanismes possibles responsables de l’absorption accrue des molécules extracellulaires. Lorsqu’il s’agit de suspensions de bulles ou de cellules telles que les tests de transfections biologiques in vitro12, la perméabilisation par microdiffusion pourrait être beaucoup plus efficace que la perméabilisation par effondrement de bulles. Cela peut être démontré par une simple considération géométrique. Dans les suspensions cellulaires, la sonoporation sera efficace si la majorité des cellules en suspension est soumise à des effets mécaniques suffisamment importants (conduisant à une perméabilisation membranaire). On sait que les effondrements de bulles sont dirigés le long de la direction de rupture de symétrie isotrope, comme l’axe bulle-paroi13 ou la bulle-bulle et la lignée bulle-cellule joignant leur centre de masse14. Le microjet produit est donc un phénomène spatialement localisé le long d’un nombre fini de raies joignant les centres de cellules et de bulles. Selon la concentration de la cellule et de la bulle, ainsi que la distance cellule-bulle, cet effet peut ne pas être le plus efficace pour perméabiliser le nombre total de cellules en suspension. En revanche, le microstreaming par cavitation est un phénomène qui se produit à une échelle de temps lente, avec une grande expansion spatiale par rapport au rayon de la bulle. De plus, le flux de liquide est réparti tout autour de la bulle, et peut donc impacter un plus grand nombre de cellules, à très longue distance. Par conséquent, la compréhension du microflux de cavitation généré autour d’une bulle oscillante est une condition préalable au contrôle et à la quantification de la contrainte de cisaillement induite par les bulles appliquée aux cellules.
Pour ce faire, une étape préliminaire consiste à contrôler les oscillations sphériques et non sphériques d’une bulle pilotée par ultrasons, car les écoulements liquides générés sont induits par le mouvement de l’interface bulle15,16. En particulier, les oscillations de forme des microbulles doivent être déclenchées et maintenues stables. De plus, l’orientation des oscillations en forme de bulle doit être contrôlée pour analyser correctement la corrélation entre la dynamique de l’interface de bulle et le motif de microdiffusion induit. En résumant la littérature existante, il est évident que les résultats expérimentaux détaillés du microflux induit par cavitation ne sont disponibles que pour les bulles attachées à une surface. Les microbulles murales sont couramment utilisées pour évaluer la dynamique précise de l’interface et les interactions cellulaires à l’échelle micrométrique dans le cadre d’un système de microscopie ultrarapide. Cette configuration est thérapeutiquement pertinente lorsque l’on considère des microbulles vibrantes situées sur la membrane cellulaire17,18,19. L’étude de la bulle attachée au substrat peut cependant rendre plus compliquée l’analyse de la dynamique des bulles, en partie en raison de la nature complexe de la dynamique des lignes de contact20 et du déclenchement de modes de forme asymétriques21. Dans les applications médicales et biologiques, les bulles qui ne sont pas attachées à un mur se trouvent couramment dans des géométries confinées telles que de petits vaisseaux. Cela a un impact significatif sur la dynamique des bulles et les instabilités de forme. En particulier, la présence d’un mur à proximité déplace le seuil de pression pour le déclenchement du mode de forme vers des valeurs de pression inférieures en fonction du numéro de mode de forme et de la taille de la bulle22. La paroi affecte également le microflux induit par les bulles avec une intensité peut-être plus élevée pour le flux produit23.
Parmi tous les scénarios possibles que les microbulles peuvent connaître (libres ou attachées, proches d’un mur, s’effondrant ou oscillant de manière stable), nous proposons d’étudier la dynamique non sphérique d’une seule bulle loin de toute frontière. La configuration expérimentale est basée sur un système de lévitation acoustique24 dans lequel une onde ultrasonore stationnaire est utilisée pour piéger la bulle. Ce scénario est cohérent avec les applications médicales dans lesquelles une collection de bulles et de cellules en suspension coexiste dans une chambre de sonotransfection, par exemple. Dans la mesure où les bulles et les cellules ne sont pas trop proches, on suppose que la présence d’une cellule n’a pas d’impact sur la dynamique de l’interface des bulles. Lorsque les cellules suivent les trajectoires en boucle du microflux induit par la cavitation, elles s’approchent cycliquement et se repoussent de l’emplacement de la bulle et nous pouvons supposer que la présence de cellules n’affecte ni le modèle d’écoulement ni sa vitesse moyenne. De plus, la dynamique non sphérique et le microflux induit à partir de bulles simples loin de la frontière sont bien connus d’un point de vue théorique. Afin de relier l’écoulement de liquide induit par les bulles à la dynamique du contour de la bulle, il est nécessaire de caractériser avec précision la dynamique de l’interface de la bulle. Pour ce faire, il est préférable d’adapter l’échelle spatio-temporelle dans les études expérimentales par rapport à celles utilisées en thérapeutique afin que l’acquisition avec des caméras à grande vitesse communes (inférieure à 1 million d’images/seconde) soit possible en utilisant de grosses bulles excitées à des fréquences plus basses. Lorsque l’on considère les bulles non revêtues, la fréquence propre ωn d’un mode n donné est liée à la taille de la bulle comme 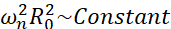 25. Cette relation rayon-fréquence propre est légèrement modifiée lorsque l’on considère les bulles décortiquées26, mais l’ordre de grandeur de la fréquence propre ωn reste le même. Ainsi, l’étude de bulles avec des rayons d’équilibre ~50μm dans un champ ultrasonore de 30 kHz est similaire à l’étude de bulles enrobées de rayons ~3μm dans un champ de 1,7 MHz, comme proposé par Dollet et al.27. Des numéros de mode de forme similaires et donc des modèles de microdiffusion sont donc attendus.
25. Cette relation rayon-fréquence propre est légèrement modifiée lorsque l’on considère les bulles décortiquées26, mais l’ordre de grandeur de la fréquence propre ωn reste le même. Ainsi, l’étude de bulles avec des rayons d’équilibre ~50μm dans un champ ultrasonore de 30 kHz est similaire à l’étude de bulles enrobées de rayons ~3μm dans un champ de 1,7 MHz, comme proposé par Dollet et al.27. Des numéros de mode de forme similaires et donc des modèles de microdiffusion sont donc attendus.
Afin de déclencher des oscillations non sphériques de l’interface à bulles, il est nécessaire de dépasser un certain seuil de pression dépendant du rayon, comme le montre la figure 1. Les techniques expérimentales existantes reposent sur l’augmentation de la pression acoustique pour déclencher des modes de surface (illustrés par le chemin (1) de la figure 1), soit par augmentation progressive de la pression28 , soit par excitation d’amplitude modulée responsable de l’apparition périodique et de l’extinction des modes de surface29. Les principaux inconvénients de ces techniques sont (i) une orientation aléatoire de l’axe de symétrie des oscillations de surface qui ne peut pas être contrôlée pour être dans le plan d’imagerie, (ii) une courte durée de vie des oscillations en forme de bulle qui rend l’analyse des écoulements de liquide induits difficile à des échelles de temps plus grandes, et (iii) le déclenchement fréquent de modes de forme instables. Nous proposons une technique alternative pour franchir le seuil de pression à pression acoustique constante dans la carte rayon/pression, comme illustré par le chemin (2) de la figure 1. Pour ce faire, il est nécessaire d’augmenter la taille de la bulle de sorte qu’elle se trouve dans la zone d’instabilité. Une telle augmentation est réalisée par une technique de coalescence de bulles. La coalescence de deux microbulles, initialement oscillantes sphériquement, est exploitée pour créer une seule bulle déformée. Si la pression acoustique et la taille de la bulle coalescée se trouvent dans la zone d’instabilité, les modes de surface sont déclenchés. Nous avons également mis en évidence que la technique de coalescence induit des oscillations de forme stable dans un régime d’état stationnaire, ainsi qu’un axe de symétrie contrôlé défini par le mouvement rectiligne des deux bulles qui s’approchent. Parce qu’une oscillation de forme stable est assurée sur quelques minutes, l’analyse de l’écoulement de fluide induit par des bulles est possible en ensemençant le milieu liquide avec des microparticules fluorescentes, éclairées par une fine feuille laser. L’enregistrement du mouvement des microparticules solides au voisinage de l’interface bulle permet d’identifier le schéma de l’écoulement du fluide induit30. Le principe général du déclenchement des oscillations en forme de bulle, conduisant à un écoulement de fluide stable dans le temps, est illustré à la figure 2.
Dans le protocole suivant, nous décrivons les étapes nécessaires pour créer des oscillations stables en forme de bulle via la technique de coalescence et décrivons les mesures de l’écoulement des fluides. Cela comprend la conception du système de lévitation acoustique, l’étalonnage acoustique, la nucléation des bulles et la technique de coalescence, la mesure de la dynamique de l’interface des bulles et de l’écoulement du fluide environnant, ainsi que le traitement de l’image.
Protocol
Representative Results
Discussion
La procédure présentée consiste à utiliser la coalescence des bulles afin de déclencher des oscillations en forme de bulle à l’état stationnaire, contrôlées par symétrie, permettant l’étude de l’écoulement de fluide à long terme induit par ces oscillations. Le principal défi de la technique est le contrôle des oscillations non sphériques pour une bulle piégée, loin de toute frontière.
La plupart des techniques existantes proposées dans la littérature se sont concentr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par le LabEx CeLyA de l’Université de Lyon (ANR-10-LABX-0060 / ANR-11-IDEX-0007).
Materials
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
References
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall – a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).

