음향 부상 시스템에서 Nonspherical Bubble Oscillations에 의한 마이크로스트리밍 유도
Summary
두 기포 사이의 유착 기술을 기반으로 하는 단일 트랩 음향 기포의 모양 진동을 제어하기 위해 빠르고 신뢰할 수 있는 기술이 제안됩니다. 정상 상태의 대칭 제어 기포 모양 진동을 통해 기포 계면 부근에서 생성된 유체 흐름을 분석할 수 있습니다.
Abstract
생물학적 장벽 근처에 위치할 때 진동하는 미세 기포는 세포막 투과성을 증가시켜 약물 및 유전자 내재화를 허용할 수 있습니다. 실험적 관찰에 따르면 이러한 장벽의 일시적인 투과화는 캐비테이션 마이크로스트리밍에 의해 세포 조직에 가해지는 전단 응력 때문일 수 있습니다. 캐비테이션 마이크로 스트리밍은 진동하는 초음파 미세 기포 주변에서 발생하는 소용돌이 흐름의 생성입니다. 이러한 액체 흐름을 생성하기 위해 기포 진동은 순전히 구형 진동에서 벗어나 병진 불안정성 또는 형상 모드를 포함해야 합니다. 기포에 의한 유동 및 주변 표면의 전단 응력에 대한 실험적 연구는 안정적이고 제어 가능한 방식으로 미세 기포의 형상 변형을 포착하기 어렵기 때문에 범위가 제한되는 경우가 많습니다. 우리는 대칭 제어 비구형 진동 연구를 위한 음향 부상 챔버의 설계를 설명합니다. 이러한 제어는 충분히 강렬한 초음파 필드에서 접근하는 두 개의 기포 사이의 유착 기술을 사용하여 수행됩니다. 비구형 진동의 제어는 자유 표면 진동 미세 기포의 제어된 캐비테이션 마이크로스트리밍으로 가는 길을 열어줍니다. 하이 프레임 레이트 카메라를 사용하면 음향 시간 척도에서 비구형 기포 역학과 더 낮은 시간 척도에서 액체 흐름을 유사 동시에 조사할 수 있습니다. 매우 다양한 유체 패턴이 얻어질 수 있으며 버블 계면의 모달 함량과 상관관계가 있는 것으로 나타났습니다. 우리는 계면 역학에 여러 모드가 포함되어 있는 경우 고차 형상 모드도 장거리 유체 패턴을 생성할 수 있음을 입증하여 표적 및 국소 약물 전달을 위한 비구형 진동의 가능성을 강조합니다.
Introduction
의학에서 투여 된 약물은 원하는 목표에 도달하기 전에 생체 시스템의 많은 장애물을 통과해야합니다. 그러나 대부분의 약물은 혈류에서 빠르게 제거됩니다. 표적화 효율이 낮고 세포막을 쉽게 통과할 수 없어 약물 전달이 비효율적입니다. 현재, 초음파와 함께 마이크로버블을 사용하는 것은 병리학적 조직과 세포에 약물과 유전자를 비침습적이고 정밀하며 표적으로 전달하기 위한 혁신적인 방법으로 제안되었다1. 이 접근법에서 미세 기포는 유리 약물이 기포 현탁액과 함께 주입되거나 표면에 적재되는 운반체 역할을 할 수 있습니다. 미세 기포는 또한 세포와 상호 작용하기 위해 초음파 에너지를 다시 집중시키는 로컬 벡터 역할을 할 수 있습니다. 기본적으로 초음파 노출 하에서 기포는 안정적으로 압축되고 팽창하며, 이는 액체 흐름을 생성하여 주변 물체에 대한 전단 응력을 발생시키는 안정 캐비테이션 (stable cavitation)이라고합니다. 미세 기포는 또한 비선형으로 진동하고 관성 캐비테이션 체제에서 붕괴될 때까지 팽창하여 붕괴 부위2에서 방사상으로 전파되는 충격파를 생성할 수 있습니다. 안정 또는 관성 캐비테이션은 세포막의 투과를 향상시켜 세포 내로의 약물의 내재화를 향상시키는 것으로 나타났다3.
치료 응용 분야에서 기포-세포 상호 작용의 메커니즘을 이해하는 것은 매우 중요하지만 과학적 측면과 기술적 측면 모두에서 우리의 지식이 발전하는 것을 방해하는 몇 가지 장벽이 있습니다. 첫째, 기포에 의한 기계적 자극에 반응하는 세포의 역학을 포착하는 것은 매우 어렵다4. 음향 시간 척도에서 1차 미세 기포 진동은 막 채널의 활성화로 이어져 생물학적 경계면을 가로지르는 분자 통과를 촉진할 수 있습니다. 이것은 “세포 마사지”라고도하는 세포막의 직접적인 진동을 통해 발생합니다.5. 직접적인 기계적 스트레스에 따른 채널 활성화는 초음파 노출 중 및 후에 세포막의 전기 생리학적 특성을 측정하는 패치 클램프 기술을 사용하여 입증되었습니다6. 음향 시간 척도에서 기포 유도 세포 역학(세포막의 완전한 변형 영역을 의미)을 측정하면 세포막에 기공을 유도하는 데 필요한 막 면적 확장 Δ A/A의 임계값에 대한 통찰력도 얻을 수 있습니다7. 두 번째 장벽은 미세 기포에 의한 세포 용해를 피하기 위해 붕괴 기포 영역을 제어하는 것입니다. 기포 붕괴 및 유도된 마이크로제트는 막 천공이 발생하는 메커니즘으로 확인되었습니다 8,9. 일단 투과되면 세포막은 지질 이중층의 칼슘 자가 밀봉과 세포내 소포의 융합을 통해 복구된다9. 기포 붕괴의 발생은 또한 세포에 치명적인 손상을 입히고 주변 세포에 불필요한 부작용을 유발할 수 있습니다. 초음파 매개 혈액뇌장벽 개방과 같은 민감한 응용 분야에서는 관성 기포 붕괴를 피해야 한다는 것이 일반적으로 받아들여지고 있다10.
그러므로, 현재 미세 기포11의 안정적인 진동을 보장하기 위해 수동 캐비테이션 모니터링 및 제어와 결합된 초음파 방출 시퀀스의 설계에 막대한 노력이 기울여지고 있다. 이 안정한 영역에서, 안정적으로 진동하는 기포는 세포막7에 대한 공간적 표적 전단 응력을 촉진함으로써 막 투과화를 촉발하는 데 강력한 역할을 한다는 가설이 세워졌다. 전단 응력은 진동하는 기포 근처에서 생성된 액체 흐름으로 인해 발생합니다. 이러한 액체 흐름을 캐비테이션 마이크로스트리밍(cavitation microstreaming)이라고 하며, 위에서 언급했듯이 세포외 분자의 흡수를 향상시키는 몇 가지 가능한 메커니즘 중 하나입니다. 시험관내 생물학적 형질감염 분석(in-vitro biological transfections)분석(12)과 같은 기포 또는 세포의 현탁액을 다룰 때, 마이크로스트리밍에 의한 투과화는 기포 붕괴에 의한 투과화보다 훨씬 더 효율적일 수 있다. 이것은 간단한 기하학적 고려로 나타낼 수 있습니다. 세포 현탁액에서, 현탁 세포의 대다수가 충분히 큰 기계적 효과 (막 투과로 이어짐)에 제출되는 경우 sonoporation이 효율적입니다. 기포 붕괴는 기포-벽 축(13 ) 또는 기포-기포와 기포-세포선이 이들의 질량 중심(14)을 연결하는 것과 같은 등방성 대칭 파괴 방향을 따라 향하는 것으로 알려져 있다. 따라서 생산 된 마이크로 제트는 세포와 기포 중심을 연결하는 유한 수의 선을 따라 공간적으로 국소화 된 현상입니다. 세포 및 기포 농도 및 기포 세포 거리에 따라 이 효과는 부유 세포 전체 수를 투과화하는 데 가장 효율적이지 않을 수 있습니다. 대조적으로, 캐비테이션 마이크로 스트리밍은 기포 반경에 비해 큰 공간 확장과 함께 느린 시간 척도에서 발생하는 현상입니다. 또한 액체 흐름은 기포 주위에 분포되어 있으므로 매우 긴 범위에서 더 많은 수의 세포에 영향을 줄 수 있습니다. 따라서 진동 기포 주변에서 생성된 캐비테이션 마이크로스트리밍을 이해하는 것은 세포에 가해지는 기포 유발 전단 응력을 제어하고 정량화하기 위한 전제 조건입니다.
그렇게 하기 위해, 예비 단계는 생성된 액체 흐름이 기포 계면(15, 16)의 운동에 의해 유도됨에 따라, 초음파-구동 기포의 구형 및 비구형 진동을 제어하는 것으로 구성된다. 특히, 미세 기포의 형상 진동이 촉발되고 안정적으로 유지되어야 합니다. 또한, 버블 형상 진동의 방향은 버블 계면 역학과 유도된 마이크로스트리밍 패턴 사이의 상관관계를 적절하게 분석하기 위해 제어되어야 합니다. 기존 문헌을 요약하면 캐비테이션 유도 마이크로스트리밍의 상세한 실험 결과는 표면에 부착된 기포에 대해서만 사용할 수 있음이 분명합니다. 벽부착형 마이크로버블은 초고속 현미경 시스템에서 마이크로미터 규모의 정확한 계면 역학 및 세포 상호 작용을 평가하는 데 일반적으로 사용됩니다. 이러한 구성은 세포막17,18,19 상에 위치된 진동 마이크로버블을 고려할 때 치료적으로 관련된다. 그러나, 기판-부착 기포에 대한 연구는 기포 동역학의 분석을 더 복잡하게 만들 수 있는데, 부분적으로는 접촉선 동역학(20)의 복잡한 특성과 비대칭 형상 모드(21)의 트리거링으로 인한 것이다. 의료 및 생물학적 응용 분야에서 벽에 부착되지 않은 기포는 일반적으로 작은 용기와 같은 제한된 형상에서 발견됩니다. 이는 기포 역학과 형상 불안정성에 상당한 영향을 미칩니다. 특히, 근처에 벽이 존재하면 형상 모드 번호와 기포 크기(22)에 따라 더 낮은 압력 값으로 트리거되는 형상 모드에 대한 압력 임계값이 이동합니다. 벽은 또한 생성된 흐름(23)에 대해 아마도 더 높은 강도로 기포-유도된 마이크로스트리밍에 영향을 미친다.
미세 기포가 경험할 수 있는 모든 가능한 시나리오(자유 또는 부착, 벽에 가까움, 붕괴 또는 안정적으로 진동) 중에서 우리는 경계에서 멀리 떨어진 단일 기포의 비구형 역학을 조사할 것을 제안합니다. 실험 설정은 기포를 포획하기 위해 스탠딩 초음파가 사용되는 음향 부상 시스템(24)에 기초한다. 이 시나리오는 예를 들어 초음파 형질주입 챔버에 부유 기포와 세포의 집합체가 공존하는 의료 응용 프로그램과 일치합니다. 기포와 세포가 너무 가깝지 않은 한, 세포의 존재는 기포 계면 역학에 영향을 미치지 않는다고 가정합니다. 세포가 캐비테이션으로 인한 마이크로스트리밍의 루프와 같은 궤적을 따를 때 주기적으로 기포 위치에 접근하고 반발하며 세포 존재가 스트리밍 패턴이나 평균 속도에 영향을 미치지 않는다고 가정할 수 있습니다. 또한, 경계에서 멀리 떨어진 단일 기포로부터의 비구형 역학 및 유도 된 마이크로 스트리밍은 이론적 관점에서 잘 알려져 있습니다. 기포에 의한 액체 흐름을 기포 윤곽 역학에 연결하려면 기포 계면 역학을 정확하게 특성화해야 합니다. 이를 위해서는 치료에 사용되는 것과 관련하여 실험 연구에서 시공간 규모를 조정하여 낮은 주파수에서 여기된 큰 기포를 사용하여 일반적인 고속 카메라(100만 프레임/초 미만)로 획득할 수 있도록 하는 것이 바람직합니다. 코팅되지 않은 기포를 고려할 때, 주어진 모드 n의 고유 주파수 ωn은 25로 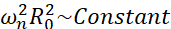 기포 크기와 관련된다. 이러한 반지름-고유주파수 관계는 쉘링된 기포(26)를 고려할 때 약간 변형되지만, 고유주파수 ωn의 크기 차수는 동일하게 유지된다. 따라서 30kHz 초음파 필드에서 평형 반경 ~ 50μm의 기포를 조사하는 것은 Dollet et al.27이 제안한 바와 같이 1.7MHz 필드에서 반경 ~ 3μm의 코팅 된 기포를 연구하는 것과 유사합니다. 따라서 유사한 모양 모드 번호와 그에 따른 마이크로스트리밍 패턴이 예상됩니다.
기포 크기와 관련된다. 이러한 반지름-고유주파수 관계는 쉘링된 기포(26)를 고려할 때 약간 변형되지만, 고유주파수 ωn의 크기 차수는 동일하게 유지된다. 따라서 30kHz 초음파 필드에서 평형 반경 ~ 50μm의 기포를 조사하는 것은 Dollet et al.27이 제안한 바와 같이 1.7MHz 필드에서 반경 ~ 3μm의 코팅 된 기포를 연구하는 것과 유사합니다. 따라서 유사한 모양 모드 번호와 그에 따른 마이크로스트리밍 패턴이 예상됩니다.
버블 계면의 비구형 진동을 트리거하려면 그림 1과 같이 반경에 따라 달라지는 특정 압력 임계값을 초과해야 합니다. 기존의 실험 기법은 단계적 압력 증가(28) 또는 표면 모드(29)의 주기적인 개시 및 소멸을 담당하는 변조된 진폭 여기(modulated-amplitude excitation)에 의해 표면 모드(그림 1의 경로 (1)으로 설명됨)를 유발하기 위해 음향 압력의 증가에 의존한다. 이러한 기술의 주요 단점은 (i) 이미징 평면에 있도록 제어할 수 없는 표면 진동의 대칭 축의 무작위 방향, (ii) 더 큰 시간 척도에서 유도된 액체 흐름의 분석을 어렵게 만드는 기포 모양 진동의 짧은 수명, 및 (iii) 불안정한 형상 모드의 빈번한 트리거링입니다. 그림 2의 경로 (1)에서 볼 수 있듯이 반경/압력 맵의 일정한 음압에서 압력 임계값을 교차하는 대체 기술을 제안합니다. 이를 위해서는 불안정 영역에 있도록 기포 크기를 늘려야 합니다. 이러한 증가는 버블 유착 기술에 의해 수행됩니다. 처음에는 구형으로 진동하는 두 개의 미세 기포의 합체가 하나의 변형된 기포를 생성하기 위해 이용됩니다. 합쳐진 기포의 음압과 기포 크기가 불안정 영역에 있으면 표면 모드가 트리거됩니다. 우리는 또한 유착 기술이 정상 상태 영역에서 안정적인 모양 진동을 유도할 뿐만 아니라 접근하는 두 기포의 직선 운동에 의해 정의되는 제어된 대칭 축을 유도한다는 것을 입증했습니다. 몇 분 동안 안정적인 형상 진동이 보장되기 때문에 얇은 레이저 시트로 조명된 형광 미세 입자로 액체 매체를 파종하여 기포 유도 유체 흐름을 분석할 수 있습니다. 버블 계면 부근에서 고체 미세입자의 움직임을 기록하는 것은 유도된 유체 흐름(30)의 패턴을 식별할 수 있게 해준다. 기포 모양 진동을 유발하여 시간 안정성이 있는 유체 흐름을 유도하는 전반적인 원리는 그림 2에 나와 있습니다.
다음 프로토콜에서는 유착 기술을 통해 안정적인 기포 모양 진동을 생성하는 데 필요한 단계를 간략하게 설명하고 유체 흐름의 측정을 설명합니다. 여기에는 음향 부상 시스템의 설계, 음향 보정, 기포 핵 형성 및 유착 기술, 기포 계면 역학 및 주변 유체 흐름 측정, 이미지 처리가 포함됩니다.
Protocol
Representative Results
Discussion
제시된 절차는 정상 상태의 대칭 제어 기포 모양 진동을 유발하기 위해 기포 유착을 사용하여 이러한 진동에 의해 유도된 장기 유체 흐름을 연구할 수 있도록 하는 것으로 구성됩니다. 이 기술의 주요 과제는 경계에서 멀리 떨어진 기포가 갇히기 위해 비구형 진동을 제어하는 것입니다.
문헌에서 제안된 현존하는 기술들의 대부분은 기판-부착 기포(7,16</s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작업은 리옹 대학의 LabEx CeLyA(ANR-10-LABX-0060 / ANR-11-IDEX-0007)의 지원을 받았습니다.
Materials
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
References
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall – a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).

