Extraction, purification et profilage des gangliosides
Summary
Les gangliosides sont des glycosphingolipides porteurs d’acide sialique qui sont particulièrement abondants dans le cerveau. Leur nature amphipathique nécessite des techniques d’extraction et de purification organiques/aqueuses pour assurer une récupération optimale et des analyses précises. Cet article fournit des aperçus de l’extraction, de la purification et de l’analyse par chromatographie sur couche mince à l’échelle analytique et préparative.
Abstract
Les gangliosides sont des glycosphingolipides qui contiennent un ou plusieurs résidus d’acide sialique. Ils se trouvent sur toutes les cellules et tissus des vertébrés, mais sont particulièrement abondants dans le cerveau. Exprimés principalement sur la feuillet externe des membranes plasmiques des cellules, ils modulent les activités des protéines de surface cellulaire par association latérale, agissent comme récepteurs dans les interactions cellule-cellule et sont des cibles pour les agents pathogènes et les toxines. La dérégulation génétique de la biosynthèse des gangliosides chez l’homme entraîne de graves troubles congénitaux du système nerveux. En raison de leur nature amphipathique, l’extraction, la purification et l’analyse des gangliosides nécessitent des techniques qui ont été optimisées par de nombreux chercheurs au cours des 80 années qui ont suivi leur découverte. Nous décrivons ici des méthodes au niveau du banc pour l’extraction, la purification et les analyses qualitatives et quantitatives préliminaires des principaux gangliosides de tissus et de cellules qui peuvent être complétées en quelques heures. Nous décrivons également des méthodes d’isolement et de purification à plus grande échelle des principales espèces de gangliosides du cerveau. Ensemble, ces méthodes fournissent un accès à l’échelle analytique et préparative à cette classe de molécules bioactives.
Introduction
Les gangliosides sont définis comme des glycosphingolipides portant un ou plusieurs résidus d’acide sialique1. Ils sont exprimés principalement à la surface de la cellule avec leur fraction lipidique céramide hydrophobe intégrée dans la feuillet externe de la membrane plasmique et leurs glycanes hydrophiles s’étendant dans l’espace extracellulaire2. Bien que largement distribués dans les cellules et les tissus des vertébrés, ils sont particulièrement abondants dans le cerveau des vertébrés3, où ils ont été découverts et nommés pour la première fois4.
Les structures des glycanes gangliosides varient et constituent la base de leur nomenclature (Figure 1). Les glycanes gangliosides sont constitués d’un noyau de sucre neutre portant différents nombres et distributions d’acides sialiques. Le plus petit ganglioside, GM4, ne contient que deux sucres (acide sialique lié au galactose)5. Les gangliosides naturels plus gros peuvent contenir plus d’une douzaine de sucres totaux6 ou jusqu’à sept acides sialiques sur un seul noyau neutre7. Leurs fractions lipidiques céramides varient également, ayant différentes longueurs de sphingosine et une variété d’amides d’acides gras. Dans le cerveau des vertébrés, quatre espèces de gangliosides, GM1, GD1a, GD1b et GT1b prédominent. L’expression du ganglioside est régulée par le développement, spécifique au tissu et spécifique au type de cellule.
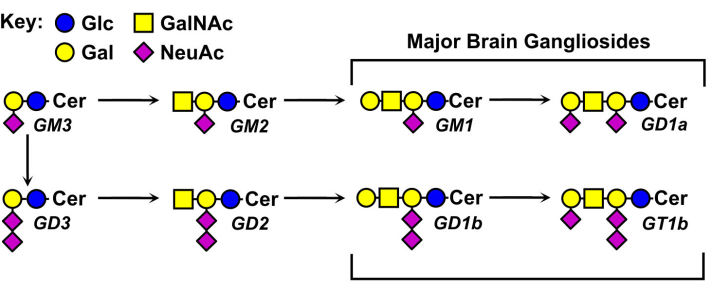
Figure 1 : Principaux gangliosides cérébraux et leurs précurseurs biosynthétiques. Les structures sont présentées à l’aide de la nomenclature des symboles pour les glycanes11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les gangliosides fonctionnent au niveau moléculaire en engageant et en modulant les protéines dans leurs propres membranes (régulation cis) ou en engageant les protéines de liaison aux glycanes dans le milieu extracellulaire, y compris les toxines bactériennes et les lectines sur d’autres cellules (trans reconnaissance)3. La liaison spécifique des gangliosides aux protéines régulatrices et/ou l’auto-association avec d’autres molécules dans des radeaux lipidiques entraîne des changements dans le comportement cellulaire qui ont un impact sur la structure et la fonction du système nerveux, la progression du cancer, le métabolisme, l’inflammation, les protéinopathies neuronales et les maladies infectieuses8. En raison de leurs divers rôles cellulaires, les méthodes d’isolement et d’analyse peuvent fournir des informations améliorées sur la régulation des processus physiologiques et pathologiques. Ici, des méthodes validées pour l’extraction et l’analyse rapides à petite échelle, et l’isolement à l’échelle préparative des gangliosides du cerveau sont fournis. Les possibilités et les défis liés à l’application à d’autres tissus sont discutés.
Protocol
Representative Results
Discussion
Les méthodes d’extraction et d’isolement des gangliosides à petite et à grande échelle décrites ici ne sont pas uniques – il existe de nombreuses approches différentes d’extraction et de purification par solvant qui donnent d’excellents résultats12. Les méthodes rapportées ici pour la purification à petite échelle du cerveau, de Fredman et Svennerholm13, ont été montrées pour optimiser la récupération et se sont avérées robustes et simples pendant …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par la subvention U01CA241953 du Fonds commun des National Institutes of Health (NIH) pour la glycoscience. MJP a été soutenu par le programme d’interface chimie-biologie de Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

