Estrazione, purificazione e profilatura del ganglioside
Summary
I gangliosidi sono glicosfingolipidi contenenti acido sialico che sono particolarmente abbondanti nel cervello. La loro natura anfipatica richiede tecniche di estrazione e purificazione organiche/acquose per garantire un recupero ottimale e analisi accurate. Questo articolo fornisce una panoramica dell’estrazione, della purificazione e dell’analisi della cromatografia su ganglioside su scala analitica e preparativa.
Abstract
I gangliosidi sono glicosfingolipidi che contengono uno o più residui di acido sialico. Si trovano su tutte le cellule e i tessuti dei vertebrati, ma sono particolarmente abbondanti nel cervello. Espressi principalmente sul foglietto esterno delle membrane plasmatiche delle cellule, modulano le attività delle proteine di superficie cellulare tramite associazione laterale, agiscono come recettori nelle interazioni cellula-cellula e sono bersagli per agenti patogeni e tossine. La disregolazione genetica della biosintesi dei gangliosidi nell’uomo provoca gravi disturbi congeniti del sistema nervoso. A causa della loro natura anfipatica, l’estrazione, la purificazione e l’analisi dei gangliosidi richiedono tecniche che sono state ottimizzate da molti ricercatori negli 80 anni dalla loro scoperta. Qui descriviamo i metodi a livello di banco per l’estrazione, la purificazione e le analisi qualitative e quantitative preliminari dei principali gangliosidi da tessuti e cellule che possono essere completati in poche ore. Descriviamo anche metodi per l’isolamento e la purificazione su larga scala delle principali specie di ganglioside dal cervello. Insieme, questi metodi forniscono accesso analitico e su scala preparativa a questa classe di molecole bioattive.
Introduction
I gangliosidi sono definiti come glicosfingolipidi portatori di uno o più residui di acido sialico1. Sono espressi principalmente sulla superficie cellulare con la loro porzione lipidica idrofobica ceramide incorporata nel foglietto esterno della membrana plasmatica e i loro glicani idrofili che si estendono nello spazio extracellulare2. Sebbene ampiamente distribuiti nelle cellule e nei tessuti dei vertebrati, sono particolarmente abbondanti nel cervello dei vertebrati3, dove sono stati scoperti e nominati per la prima volta4.
Le strutture dei gangliosidi glicani variano e sono alla base della loro nomenclatura (Figura 1). I glicani gangliosidici sono costituiti da un nucleo di zucchero neutro con diversi numeri e distribuzioni di acidi sialici. Il ganglioside più piccolo, GM4, ha solo due zuccheri (acido sialico legato al galattosio)5. I gangliosidi naturali più grandi possono contenere ben oltre una dozzina di zuccheri totali6 o fino a sette acidi sialici su un singolo nucleo neutro7. Anche le loro parti lipidiche di ceramide variano, avendo diverse lunghezze di sfingosina e una varietà di ammidi di acidi grassi. Nel cervello dei vertebrati predominano quattro specie di gangliosidi, GM1, GD1a, GD1b e GT1b. L’espressione del ganglioside è regolata dallo sviluppo, specifica del tessuto e specifica del tipo cellulare.
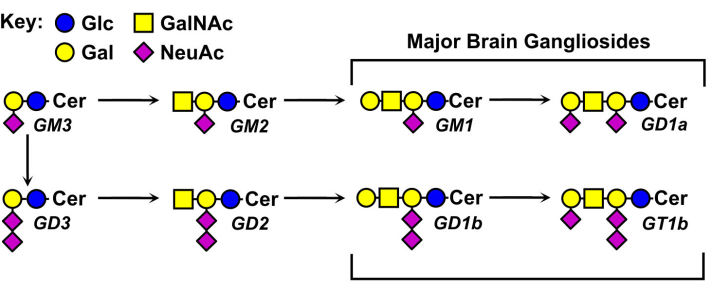
Figura 1: Principali gangliosidi cerebrali e loro precursori biosintetici. Le strutture sono mostrate usando la nomenclatura dei simboli per Glycans11. Fare clic qui per visualizzare una versione più grande di questa figura.
I gangliosidi funzionano a livello molecolare coinvolgendo e modulando le proteine nelle proprie membrane (regolazione cis) o coinvolgendo le proteine leganti i glicani nell’ambiente extracellulare, comprese le tossine batteriche e le lectine su altre cellule (trans riconoscimento)3. Il legame specifico dei gangliosidi alle proteine regolatrici e/o l’autoassociazione con altre molecole in zattere lipidiche provoca cambiamenti nel comportamento cellulare che influiscono sulla struttura e sulla funzione del sistema nervoso, sulla progressione del cancro, sul metabolismo, sull’infiammazione, sulle proteinopatie neuronali e sulle malattie infettive8. A causa dei loro diversi ruoli cellulari, i metodi per il loro isolamento e analisi possono fornire maggiori informazioni sulla regolazione dei processi fisiologici e patologici. Qui vengono forniti metodi convalidati per l’estrazione e l’analisi rapide su piccola scala e l’isolamento su scala preparativa dei gangliosidi dal cervello. Vengono discusse le opportunità e le sfide per l’applicazione ad altri tessuti.
Protocol
Representative Results
Discussion
I metodi per l’estrazione e l’isolamento del ganglioside su piccola e grande scala qui riportati non sono unici: ci sono molti diversi approcci di estrazione e purificazione con solvente che forniscono risultati eccellenti12. I metodi riportati qui per la purificazione su piccola scala dal cervello, da Fredman e Svennerholm13, hanno dimostrato di ottimizzare il recupero e hanno dimostrato di essere robusti e diretti per molti anni nel nostro laboratorio. L’isolamento e la p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato supportato dalla sovvenzione U01CA241953 del National Institutes of Health (NIH). MJP è stato supportato dal Chemistry-Biology Interface Program presso Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

