Экстракция, очистка и профилирование ганглиозидов
Summary
Ганглиозиды представляют собой гликосфинголипиды, несущие сиаловую кислоту, которые особенно распространены в головном мозге. Их амфипатическая природа требует органической / водной экстракции и методов очистки для обеспечения оптимального восстановления и точного анализа. В данной статье представлены обзоры аналитической и препаративной ганглиозидной экстракции, очистки и тонкослойного хроматографического анализа.
Abstract
Ганглиозиды представляют собой гликосфинголипиды, которые содержат один или несколько остатков сиаловой кислоты. Они встречаются на всех клетках и тканях позвоночных, но особенно распространены в мозге. Экспрессируемые преимущественно на внешнем листочке плазматических мембран клеток, они модулируют активность белков клеточной поверхности через латеральную ассоциацию, действуют как рецепторы в клеточно-клеточных взаимодействиях и являются мишенями для патогенов и токсинов. Генетическая дисрегуляция биосинтеза ганглиозидов у человека приводит к тяжелым врожденным расстройствам нервной системы. Из-за их амфипатической природы извлечение, очистка и анализ ганглиозидов требуют методов, которые были оптимизированы многими исследователями за 80 лет с момента их открытия. Здесь мы описываем настольные методы экстракции, очистки и предварительного качественного и количественного анализа основных ганглиозидов из тканей и клеток, которые могут быть завершены за несколько часов. Мы также описываем методы более масштабного выделения и очистки основных видов ганглиозидов из мозга. Вместе эти методы обеспечивают аналитический и препаративный доступ к этому классу биологически активных молекул.
Introduction
Ганглиозиды определяются как гликосфинголипиды, несущие один или несколько остатков сиаловой кислоты1. Они экспрессируются главным образом на поверхности клетки с их гидрофобным церамидным липидным фрагментом, встроенным во внешний листок плазматической мембраны, и их гидрофильными гликанами, простирающимися во внеклеточное пространство2. Хотя они широко распространены в клетках и тканях позвоночных, они особенно распространены в мозге позвоночных3, где они были впервые обнаружены и названы4.
Структуры ганглиозидных гликанов различаются и являются основой для их номенклатуры (рисунок 1). Ганглиозидные гликаны состоят из нейтрального сахарного ядра, несущего различное количество и распределение сиаловых кислот. Самый маленький ганглиозид, GM4, имеет только два сахара (сиаловая кислота, связанная с галактозой)5. Более крупные природные ганглиозиды могут содержать более десятка общих сахаров6 или до семи сиаловых кислот на одном нейтральном ядре7. Их керамидные липидные фрагменты также различаются, имея различную длину сфингозина и различные амиды жирных кислот. В мозге позвоночных преобладают четыре вида ганглиозидов, GM1, GD1a, GD1b и GT1b. Экспрессия ганглиозидов регулируется развитием, специфична для тканей и специфична для типа клеток.
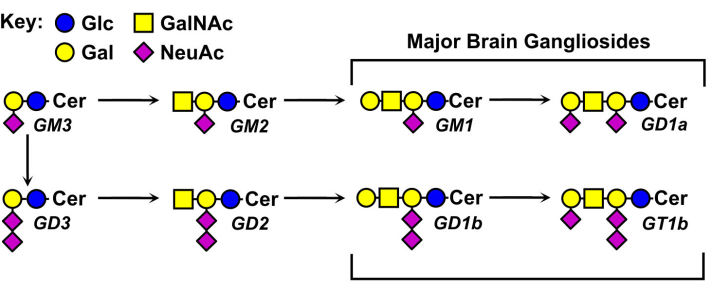
Рисунок 1: Основные ганглиозиды мозга и их биосинтетические предшественники. Структуры показаны с использованием номенклатуры символов для гликанов11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Ганглиозиды функционируют на молекулярном уровне, вовлекая и модулируя белки в своих собственных мембранах (цис-регуляция) или вовлекая гликансвязывающие белки во внеклеточную среду, включая бактериальные токсины и лектины на других клетках (транс-распознавание)3. Специфическое связывание ганглиозидов с регуляторными белками и/или самоассоциация с другими молекулами в липидные рафты приводит к изменениям в поведении клеток, которые влияют на структуру и функцию нервной системы, прогрессирование рака, метаболизм, воспаление, протеинопатии нейронов и инфекционные заболевания8. Из-за их разнообразных клеточных ролей методы их изоляции и анализа могут обеспечить более глубокое понимание регуляции физиологических и патологических процессов. Здесь представлены проверенные методы быстрой мелкомасштабной экстракции и анализа, а также экстрактивного масштабирования ганглиозидов из мозга. Обсуждаются возможности и проблемы для применения к другим тканям.
Protocol
Representative Results
Discussion
Методы мелкой и крупномасштабной экстракции и выделения ганглиозидов, о которых здесь сообщается, не являются уникальными – существует множество различных подходов к экстракции и очистке растворителем, которые обеспечивают отличные результаты12. Методы, описанные здесь д…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Грантом Общего фонда национальных институтов здравоохранения (NIH) для гликонауки U01CA241953. MJP поддерживался программой химико-биологического интерфейса в Университете Джона Хопкинса (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

