Summary
Gangliosides são glicósfoliópidos portadores de ácido sálico que são particularmente abundantes no cérebro. Sua natureza anfíppática requer técnicas orgânicas/aquosas de extração e purificação para garantir uma recuperação ideal e análises precisas. Este artigo fornece visões gerais da extração de ganglioside em escala analítica e preparatória, purificação e análise de cromatografia de camada fina.
Abstract
Gangliosides são glicosfingolipidos que contêm um ou mais resíduos de ácido sálico. Eles são encontrados em todas as células vertebrados e tecidos, mas são especialmente abundantes no cérebro. Expressos principalmente no folheto externo das membranas plasmáticas das células, eles modulam as atividades das proteínas da superfície celular via associação lateral, atuam como receptores nas interações células-células e são alvos de patógenos e toxinas. A desregulação genética da biossíntese ganglioside em humanos resulta em graves distúrbios do sistema nervoso congênito. Devido à sua natureza anfípppica, a extração, a purificação e a análise de gangliosides exigem técnicas que foram otimizadas por muitos investigadores nos 80 anos desde sua descoberta. Aqui, descrevemos métodos de nível de bancada para a extração, purificação e análises qualitativas e quantitativas preliminares de grandes gangliosides de tecidos e células que podem ser completadas em poucas horas. Também descrevemos métodos para isolamento em maior escala e purificação de grandes espécies de ganglioside do cérebro. Juntos, esses métodos proporcionam acesso analítico e de escala preparatória a essa classe de moléculas bioativas.
Introduction
Os gangliosides são definidos como glicosfingolipids com um ou mais resíduos de ácido sálico1. Eles são expressos principalmente na superfície celular com sua moiety lipídica de ceramida hidrofóbica incorporada no folheto externo da membrana plasmática e seus glicanos hidrofílicos estendendo-se para o espaço extracelular2. Embora amplamente distribuídas em células vertebradas e tecidos, elas são particularmente abundantes no cérebro vertebrado3, onde foram descobertos pela primeira vez e nomeados4.
As estruturas dos glicanos gangliosas variam e são a base para sua nomenclatura (Figura 1). Os glicanos ganglios são compostos por um núcleo de açúcar neutro com diferentes números e distribuições de ácidos sálicos. O menor ganglioside, GM4, tem apenas dois açúcares (ácido sálico ligado à galactose)5. Gangliosides maiores e naturais podem conter bem mais de uma dúzia de açúcares totais6 ou até sete ácidos sálicos em um único núcleo neutro7. Seus moieties lipídios de ceramida também variam, tendo diferentes comprimentos de sphingosina e uma variedade de amides de ácido graxo. No cérebro vertebrado predominam quatro espécies de ganglioside, GM1, GD1a, GD1b e GT1b. A expressão ganglioside é regulada pelo desenvolvimento, específica do tecido e tipo celular específico.
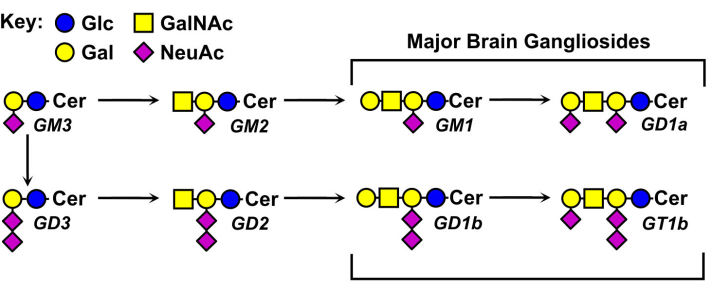
Figura 1: Grandes gângsteres cerebrais e seus precursores biossintéticos. As estruturas são mostradas usando a nomenclatura de símbolos para Glycans11. Clique aqui para ver uma versão maior desta figura.
Os ganglios funcionam no nível molecular ao engajar e modular proteínas em suas próprias membranas (regulação cis) ou por envolver proteínas de ligação glica no meio extracelular, incluindo toxinas bacterianas e lectinas em outras células (reconhecimento trans)3. A ligação específica de gangliosides a proteínas regulatórias e/ou auto-associação com outras moléculas em vigas lipídicas resulta em mudanças no comportamento celular que impactam a estrutura e função do sistema nervoso, progressão do câncer, metabolismo, inflamação, proteinopatias neuronais e doenças infecciosas8. Devido às suas diversas funções celulares, os métodos para seu isolamento e análise podem fornecer insights aprimorados sobre a regulação dos processos fisiológicos e patológicos. Aqui, são fornecidos métodos validados para extração e análise rápida em pequena escala e isolamento em escala preparatória de gangliosides do cérebro. São discutidas oportunidades e desafios para a aplicação a outros tecidos.
Protocol
Representative Results
Discussion
Os métodos de extração e isolamento de ganglioside de pequeno e grande porte relatados aqui não são únicos – existem muitas abordagens diferentes de extração e purificação de solventes que fornecem excelentes resultados12. Os métodos relatados aqui para purificação em pequena escala do cérebro, de Fredman e Svennerholm13, mostraram-se para otimizar a recuperação e provaram ser robustos e diretos ao longo de muitos anos em nosso laboratório. O isolamento e p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pelo Fundo Comum dos Institutos Nacionais de Saúde (NIH) para a concessão da Glicociência U01CA241953. O MJP foi apoiado pelo Programa de Interface Química-Biologia da Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

