Utvinning, rening och profilering av gangliosid
Summary
Gangliosider är sialinsyrabärande glykosfingolipider som är särskilt rikliga i hjärnan. Deras amfipatiska natur kräver organiska/vattenhaltiga extraktions- och reningstekniker för att säkerställa optimal återvinning och noggranna analyser. Den här artikeln innehåller översikter över analytisk och preparativ skala gangliosidextraktion, rening och tunnskiktskromatografianalys.
Abstract
Gangliosider är glykosfingolipider som innehåller en eller flera sialinsyrarester. De finns på alla ryggradsdjurs celler och vävnader men är särskilt rikliga i hjärnan. Uttryckt främst på den yttre bipacksedeln i cellernas plasmamembran modulerar de aktiviteterna hos cellytproteiner via lateral association, fungerar som receptorer i cell-cellinteraktioner och är mål för patogener och toxiner. Genetisk dysregulering av gangliosidbiosyntes hos människor resulterar i allvarliga medfödda nervsystemet. På grund av deras amfipatiska natur kräver extraktion, rening och analys av gangliosider tekniker som har optimerats av många utredare under de 80 åren sedan deras upptäckt. Här beskriver vi bänknivåmetoder för extraktion, rening och preliminära kvalitativa och kvantitativa analyser av större gangliosider från vävnader och celler som kan slutföras på några timmar. Vi beskriver också metoder för storskalig isolering och rening av större gangliosidarter från hjärnan. Tillsammans ger dessa metoder analytisk och preparativ skala tillgång till denna klass av bioaktiva molekyler.
Introduction
Gangliosider definieras som glykosfingolipider som bär på en eller flera sialinsyrarester1. De uttrycks främst vid cellytan med sin hydrofoba ceramidlipiddel inbäddad i plasmamembranets yttre bipacksedel och deras hydrofila glykaner som sträcker sig in i det extracellulära utrymmet2. Även om de förekommer i stor utsträckning i ryggradsdjurens celler och vävnader är de särskilt rikliga i ryggradsdjurens hjärna3, där de först upptäcktes och namngavs4.
Strukturerna hos gangliosidglykaner varierar och ligger till grund för deras nomenklatur (figur 1). Gangliosidglykaner består av en neutral sockerkärna som bär olika antal och fördelningar av sialinsyror. Den minsta gangliosiden, GM4, har endast två sockerarter (sialinsyra bunden till galaktos)5. Större naturligt förekommande gangliosider kan innehålla långt över ett dussin sockerarter totalt6 eller upp till sju sialinsyror på en enda neutral kärna7. Deras ceramidlipiddel varierar också, med olika sfingosinlängder och en mängd olika fettsyraamider. I ryggradsdjurens hjärna dominerar fyra gangliosidarter, GM1, GD1a, GD1b och GT1b. Gangliosiduttryck är utvecklingsreglerat, vävnadsspecifikt och celltypsspecifikt.
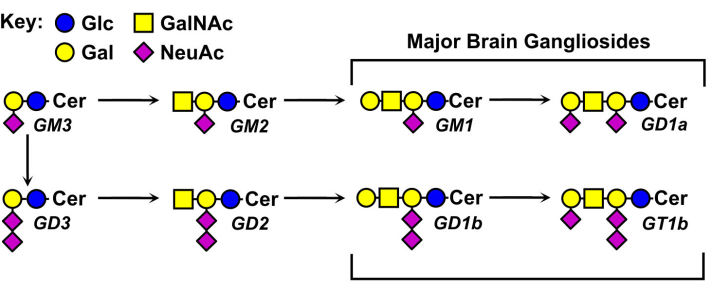
Figur 1: Stora hjärngangliosider och deras biosyntetiska prekursorer. Strukturer visas med symbolnomenklatur för glykaner11. Klicka här för att se en större version av denna figur.
Gangliosider fungerar på molekylär nivå genom att engagera och modulera proteiner i sina egna membran (cis-reglering) eller genom att engagera glykanbindande proteiner i den extracellulära miljön, inklusive bakterietoxiner och lektiner på andra celler (transigenkänning)3. Specifik bindning av gangliosider till reglerande proteiner och/eller självassociation med andra molekyler i lipidflottar resulterar i förändringar i cellbeteende som påverkar nervsystemets struktur och funktion, cancerprogression, metabolism, inflammation, neuronala proteinopatier och infektionssjukdomar8. På grund av deras olika cellulära roller kan metoder för deras isolering och analys ge ökad insikt i regleringen av fysiologiska och patologiska processer. Här tillhandahålls validerade metoder för snabb småskalig extraktion och analys samt preparativ skalisolering av gangliosider från hjärnan. Möjligheter och utmaningar för applicering på andra vävnader diskuteras.
Protocol
Representative Results
Discussion
Metoderna för extraktion och isolering av gangliosid som rapporteras här är inte unika – det finns många olika metoder för extraktion och rening av lösningsmedel som ger utmärkta resultat12. De metoder som här redovisas för småskalig rening från hjärnan, från Fredman och Svennerholm13, har visat sig optimera återhämtningen och har under många år visat sig vara robusta och okomplicerade i vårt laboratorium. Isolering och rening som är lämplig för TLC o…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av National Institutes of Health (NIH) Common Fund for Glycoscience grant U01CA241953. MJP stöddes av Chemistry-Biology Interface Program vid Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

