אסטרטגיית העשרת ספין-טיפ לניתוח סימולטני של N-גליקופפטידים ופוספופפטידים מרקמות הלבלב האנושיות
Summary
שינויים לאחר התרגום (PTMs) משנים את המבנים והתפקודים של חלבונים. שיטות להעשרה בו-זמנית של סוגי PTM מרובים יכולות למקסם את הכיסוי בניתוחים. אנו מציגים פרוטוקול באמצעות כרומטוגרפיית זיקה מתכתית משותקת Ti(IV) דו-תפקודית ואחריה ספקטרומטריית מסה להעשרת וניתוח בו זמנית של חלבון N-גליקוזילציה וזרחון ברקמות הלבלב.
Abstract
ספקטרומטריית מסות יכולה לספק כיסוי מעמיק של שינויים לאחר התרגום (PTMs), אם כי העשרה של שינויים אלה ממטריצות ביולוגיות מורכבות נחוצה לעתים קרובות בשל הסטויכיומטריה הנמוכה שלהם בהשוואה לאנליטים שאינם משתנים. רוב תהליכי ההעשרה של PTMs על פפטידים בתהליכי עבודה של פרוטאומיקה מלמטה למעלה, שבהם חלבונים מתעכלים באופן אנזימטי לפני שנותחים את הפפטידים המתקבלים, מעשירים רק סוג אחד של שינוי. עם זאת, כל ההשלמה של PTMs היא שמובילה לתפקודים ביולוגיים, והעשרת סוג אחד של PTM עלולה לפספס הצלבה כזו של PTMs. הצלבת PTM נצפתה בין גליקוזילציה של חלבונים לזרחון, שני ה-PTMs הנפוצים ביותר בחלבונים אנושיים וגם שני ה-PTMs הנחקרים ביותר באמצעות זרימות עבודה של ספקטרומטריית מסות. באמצעות אסטרטגיית ההעשרה הבו-זמנית המתוארת כאן, שני ה-PTMs מועשרים מרקמת לבלב אנושית שלאחר המוות, מטריצה ביולוגית מורכבת. כרומטוגרפיית זיקה מתכתית משותקת Ti(IV) דו-תפקודית משמשת להפרדת צורות שונות של גליקוסילציה וזרחון בו זמנית במספר שברים בשיטה נוחה המבוססת על קצה ספין, ומאפשרת ניתוחים במורד הזרם של אינטראקציות פוטנציאליות של PTM crosstalk. ניתן ליישם את זרימת העבודה הזו של העשרה עבור גליקו ופוספופפטידים על סוגי דגימות שונים כדי להשיג פרופיל עמוק של מספר PTMs ולזהות מולקולות מטרה פוטנציאליות למחקרים עתידיים.
Introduction
שינויים פוסט-תרגומיים של חלבונים (PTMs) ממלאים תפקיד מרכזי בוויסות מבני חלבונים וכתוצאה מכך בתפקודם ובתהליכים ביולוגיים במורד הזרם. המגוון של הפרוטאום האנושי גדל באופן אקספוננציאלי בשל השונות הקומבינטורית הניתנת על ידי PTMs שונים. גרסאות שונות של חלבונים מהרצפים הקאנוניים שלהם כפי שנחזה על ידי הגנום ידועות בשם פרוטאופורמים, ופרוטאופורמים רבים נובעים מ- PTMs1. חקר מגוון הפרוטאופורמים בבריאות ובמחלות הפך לתחום מחקר בעל עניין רב בשנים האחרונות 2,3.
המחקר של פרוטאופורמים וליתר דיוק PTMs עם עומק רב הפך facile יותר באמצעות פיתוח של ספקטרומטריית מסה (MS) מבוסס שיטות פרוטאומיקה מבוססות. באמצעות טרשת נפוצה, האנליטים מיוננים, מקוטעים ומזהים על סמך m/z של שברים. שיטות העשרה נחוצות לעתים קרובות בשל השפע היחסי הנמוך של PTMs בהשוואה לצורות חלבונים שלא שונו. אף על פי שניתוח של חלבונים שלמים וה-PTMs שלהם, הנקראים ניתוחים מלמעלה למטה, הפכו לשגרתיים יותר, העיכול האנזימטי של חלבונים וניתוח הפפטידים המרכיבים אותם באנליזות מלמטה למעלה הוא עדיין המסלול הנפוץ ביותר לניתוח PTM. שני ה-PTMs הנחקרים ביותר, ושני ה-PTMs הנפוצים ביותר ב-vivo, הם גליקוזילציה וזרחון4. שני PTMs אלה ממלאים תפקידים מרכזיים באיתות וזיהוי תאים ולכן הם שינויים חשובים שיש לאפיין בחקר מחלות.
התכונות הכימיות של PTMs שונים מספקות לעתים קרובות נתיבים לקראת העשרה של PTMs אלה ברמות החלבון והפפטידים לפני הניתוח. גליקוזילציה היא PTM הידרופילי בשל שפע של קבוצות הידרוקסיל על כל חד-סוכר. ניתן להשתמש בתכונה זו כדי להעשיר את הגליקופפטידים בכרומטוגרפיה של אינטראקציה הידרופילית (HILIC), שיכולה להפריד בין גליקופפטידים הידרופיליים יותר לבין הפפטידים ההידרופוביים שאינם מהונדסים5. פוספורילציה מוסיפה את הפוספט מואטי, אשר נטען שלילית למעט ב- pH חומצי. בשל מטען זה, ניתן להשתמש בקטיונים שונים של מתכות, כולל טיטניום, כדי למשוך ולקשור פוספופפטידים בזמן שמינים שאינם זרחניים נשטפים. זהו העיקרון של כרומטוגרפיית זיקה מתכתית משותקת (IMAC). דיונים נוספים על אסטרטגיות העשרה אלה ואחרות לגליקוסילציה וזרחון ניתן למצוא בסקירות אחרונות 6,7.
כמויות גדולות יחסית של חומר פפטידי מתחיל (0.5 מ”ג או יותר) נחוצות לעתים קרובות לפרוטוקולי העשרה בשל הסטויכיומטריה הנמוכה של PTMs על פפטידים. בתרחישים שבהם כמות זו של דגימה עשויה שלא להתקבל בקלות, כגון ביופסיה של ליבת הגידול או ניתוחי נוזל מוחי, כדאי להשתמש בתהליכי עבודה של facile המביאים למידע ביומולקולרי מרבי. אסטרטגיות אחרונות שפותחו על ידי המעבדה שלנו ואחרות הדגישו את הניתוח הבו-זמני והמקביל של גליקוזילציה וזרחון באמצעות אותה זרימת עבודה להעשרת PTM 8,9,10,11,12. אף על פי שהתכונות הכימיות של שני PTMs אלה עשויות להיות שונות, ניתן לנתח PTMs אלה במספר שלבים בשל טכניקות ההפרדה והחומרים החדשניים שבהם נעשה שימוש. לדוגמה, כרומטוגרפיית של דחייה אלקטרוסטטית-הידרופילית (ERLIC) מכסה הפרדות המבוססות על אינטראקציות הידרופיליות בין אנליטים לבין הפאזה הניידת עם אינטראקציות מטען-מטען בין אנליטים לבין חומר הפאזה הנייח 13,14,15,16. ב-pH חומצי, המשיכה של פפטידים זרחניים לשלב הנייח יכולה לשפר את שימורם וההפרדה שלהם מפפטידים שאינם מהונדסים. ניתן להשתמש בחומר המורכב מ-Ti(IV) המשותק במיקרו-ספירות הידרופיליות עבור אלוטיון מבוסס HILIC ו-IMAC כדי להפריד בין פוספופפטידים לבין גליקופפטידים ניטרליים, חומציים וזרחניים מנוז-6-זרחוניים 17,18. אסטרטגיה זו ידועה בשם Ti(IV)-IMAC דו-פונקציונלי. שימוש באסטרטגיות אלה להעשרת מספר PTMs בתהליך עבודה יחיד יכול להפוך ניתוחים של אינטראקציות פוטנציאליות של PTM crosstalk לנגישים יותר. בנוסף, סך כל דרישות כמות המדגם והזמן נמוך משיטות ההעשרה המקובלות כאשר הן מבוצעות במקביל (כלומר, HILIC ו- IMAC על אליקוטים מדגמיים נפרדים).
כדי להדגים את אסטרטגיית Ti(IV)-IMAC הדו-תפקודית לניתוח סימולטני של גליקוסילציה וזרחון של חלבונים, יישמנו אותה כדי לנתח רקמות לבלב אנושיות לאחר המוות. הלבלב מייצר גם אנזימי עיכול וגם הורמונים מווסתים, כולל אינסולין וגלוקגון. תפקוד הלבלב נפגע במחלת הלבלב. בסוכרת, הרגולציה של רמת הסוכר בדם מושפעת, מה שמוביל לרמות גבוהות יותר של גלוקוז בדם. בדלקת הלבלב, דלקת נובעת מעיכול אוטומטי של האיבר3. שינויים בפרופילי PTM, כולל גליקוזילציה וזרחון, עלולים לגרום, כפי שקורה לעתים קרובות, למחלות אחרות.
כאן אנו מתארים פרוטוקול לשיטת העשרה סימולטנית מבוססת ספין-טיפ, המבוססת על אסטרטגיית Ti(IV)-IMAC דו-תפקודית, עבור N-גליקופפטידים ופוספופפטידים המופקים מחלבונים המופקים מרקמת הלבלב. הפרוטוקול כולל מיצוי ועיכול של חלבונים, העשרה, איסוף נתונים של טרשת נפוצה ועיבוד נתונים, כפי שניתן לראות באיור 1. נתונים מייצגים ממחקר זה זמינים באמצעות קונסורציום ProteomeXchange עם מזהה PXD033065.
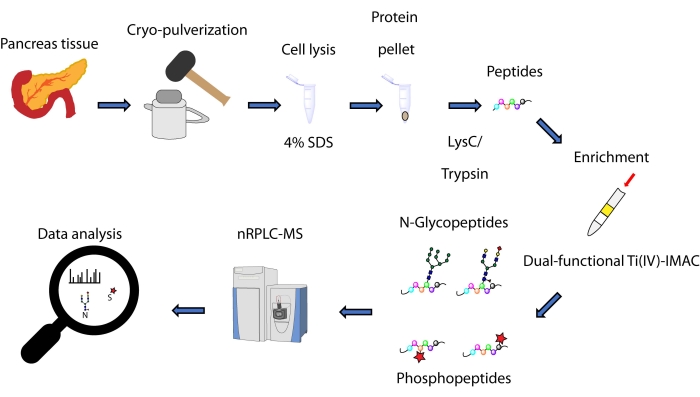
איור 1: זרימת עבודה לניתוח סימולטני של N-גליקופפטידים ופוספופפטידים מרקמות הלבלב האנושיות. הרקמות עוברות תחילה לאבקה דקה לפני מיצוי החלבון באמצעות חומר הניקוי נתרן דודציל סולפט (SDS). חלבונים נתונים לאחר מכן לעיכול אנזימטי. הפפטידים המתקבלים עוברים קרדיט לפני ההעשרה באמצעות Ti(IV)-IMAC דו-תפקודי. הנתונים הגולמיים נאספים באמצעות ספקטרומטריית כרומטוגרפיה-מסה נוזלית ננומטרית בקנה מידה הפוך הפוך (nRPLC-MS) ומנותחים באמצעות תוכנת חיפוש מסד נתונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
פרוטוקול זה נועד להפוך את ניתוחי ה-PTM לנגישים יותר ולאפשר ניתוח נרחב יותר של מספר PTMs באותה זרימת עבודה. פרוטוקול זה יכול להיות מיושם על מטריצות ביולוגיות מורכבות אחרות, כולל תאים וביופילודים.
Protocol
Representative Results
Discussion
אסטרטגיית Ti(IV)-IMAC הדו-תפקודית שימושית לניתוח סימולטני של N-גליקופפטידים ופוספופפטידים מאותה דגימה בתהליך עבודה של הכנת דגימה אחת. כמו כן, הודגם כי שיטות מבוססות ERLIC מבצעות העשרה בו-זמנית של PTMs. שתי האסטרטגיות שימשו בעבר לכיסוי עמוק בניתוחי PTM14,18. בהתאמת שיטת Ti…
Disclosures
The authors have nothing to disclose.
Acknowledgements
מחקר זה נתמך בחלקו על ידי מימון מענקים מה-NIH (R01DK071801, RF1AG052324, P01CA250972 ו-R21AG065728), והקרן לחקר סוכרת נעורים (1-PNF-2016-250-S-B ו-SRA-2016-168-S-B). הנתונים שהוצגו כאן הושגו בחלקם גם באמצעות תמיכה מפרס NIH/NCATS UL1TR002373 באמצעות המכון למחקר קליני ותרגומי של אוניברסיטת ויסקונסין. מכשירי Orbitrap נרכשו בתמיכת מענק מכשירים משותף של NIH (NIH-NCRR S10RR029531) ומשרד סגן הקנצלר למחקר וחינוך לתארים מתקדמים באוניברסיטת ויסקונסין-מדיסון. אנו רוצים גם להודות על התמיכה הנדיבה של הארגון לתרומת איברים ורקמות של אוניברסיטת ויסקונסין שסיפק לבלב אנושי למחקר ולעזרתם של דן טרמל, ד”ר שרה ד. סקט ופרופ’ ג’ון אודוריקו על אספקת הדגימות למעבדה שלנו. צוות המחקר שלנו רוצה להודות תודה מיוחדת למשפחות שתרמו רקמות למחקר זה. L.L. מכיר במענק NIH S10OD025084, במענק פיילוט לסרטן הלבלב ממרכז הסרטן הקרבוני של אוניברסיטת ויסקונסין (233-AAI9632), כמו גם בפרופסור להישגים מכובדים של וילאס ובפרופסור הקתדרה המצטיין על שם צ’ארלס מלבורן ג’ונסון במימון הקרן לחקר בוגרי ויסקונסין ובית הספר לרוקחות של אוניברסיטת ויסקונסין-מדיסון.
Materials
| Acetic Acid, Glacial (Certified ACS) | Fisher Scientific | A38S-500 | |
| Acetone (Certified ACS) | Fisher Scientific | A18-1 | |
| Acetonitrile, Optima LC/MS Grade | Fisher Scientific | A955-4 | |
| Ammonium Acetate (Crystalline/Certified ACS) | Fisher Scientific | A637-500 | |
| Ammonium Hydroxide (Certified ACS Plus) | Fisher Scientific | A669-212 | |
| Byonic software | Protein Metrics | n/a | Commercial software used for glycoproteomic analysis (https://proteinmetrics.com/byos/) |
| C18 BEH material | Waters | 186002353 | Material removed from column and used to pack nano capillaries (pulledto integrate tip used directly in line with instrument inlet) |
| CAE-Ti-IMAC, 100% | J&K Scientific | 2749380-1G | Material used for dual-functional Ti(IV)-IMAC; can also be used for conventional IMAC/conventional phosphopeptide enrichment |
| Cellcrusher kit | Cellcrusher | n/a | Used for grinding tissue samples into powder before extraction |
| Eppendorf 5424R Microcentrifuge | Fisher Scientific | 05-401-205 | For temperature-controlled centrifugation |
| cOmplete protease inhibitor cocktail tablets | Sigma | 11697498001 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | V3151 | Protein reducing agent |
| Ethanol, 200 proof (100%), USP | Fisher | 22-032-601 | |
| Fisherbrand Analog Vortex Mixer | Fisher Scientific | 02-215-414 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (1.5 mL) | Fisher Scientific | 02-681-320 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (2 mL) | Fisher Scientific | 02-681-321 | |
| Fisherbrand Model 120 Sonic Dismembrator | Fisher Scientific | FB120110 | For sample lysis using ultrasonication |
| Formic Acid, 99.0+%, Optima LC/MS Grade | Fisher Scientific | A117-50 | |
| Fused silica capillary (75 μm inner diameter, 360 μm outer diameter) | Polymicro Technologies LLC | 100 m TSP075375 | For in-house pulled and packed columns with integrated emitter |
| Hydrofluoric acid (48 wt. % in H2O) | Sigma-Aldrich | 339261-100ML | Used for opening emitter of pulled capillary column |
| Iodoacetamide, BioUltra | Sigma | I1149-5G | Protein reducing reagent |
| MaxQuant software | n/a | n/a | Free software used for phosphoproteomic analysis (https://www.maxquant.org/) |
| Multi-therm Shaker with heating and cooling | Benchmark Scientific | H5000-HC | Heating block |
| Oasis HLB 1 cc Vac Cartridge, 10 mg Sorbent per Cartridge, 30 µm, 100/pk | Waters | 186000383 | Larger-scale cartridge desalting for tryptic digests (loading capacity approximately up to 1 mg each) |
| OMIX C18 pipette tips, 100 µL tip, 10 – 100 μL elution volume, 1 x 96 tips | Agilent | A57003100 | Smaller-scale packed pipette tip for desalting for enrichment elutions |
| P-2000 Micropipette Puller | Sutter Instrument Co. | P-2000/F | For pulling nano-capillary columns for LC-MS |
| PhosSTOP phosphatase inhibitor tablets | Sigma | 4906845001 | |
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| PolySAX LP (12 μm, pore size 300 Å) | PolyLC | BMSX1203 | Material for strong anion-exchange chromatography used for ERLIC/conventional glycopeptide enrichment |
| Potassium Phosphate Monobasic (Crystalline/Certified ACS) | Fisher Scientific | P285-500 | |
| Pressure injection cell with integrated magnetic stirplate | Next Advance | PC77-MAG | For packing nano-capillary columns with stationary phase up to 2500 psi limit |
| Proteome Discoverer software | Thermo Fisher Scientific | n/a | Commercial software for proteomics anaysis (with integrated database searching software nodes) and data visualization (https://www.thermofisher.com/us/en/home/industrial/mass-spectrometry/liquid-chromatography-mass-spectrometry-lc-ms/lc-ms-software/multi-omics-data-analysis/proteome-discoverer-software.html) |
| SpeedVac SC110 Vacuum Concentrator Model SC110-120 | Savant | n/a | Centrifugal vacuum concentrator for drying samples (under heat) |
| SDS Solution, 10% Sodium Dodecyl Sulfate Solution, Molecular Biology/Electrophoresis | Fisher Scientific | BP2436200 | |
| Sequencing Grade Modified Trypsin | Promega | V5111 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| TopTip, Empty, 10-200 µL, Pack of 96 | Glygen Corporation | TT2EMT.96 | Empty pipette tip with micron-sized hole used that can be used to pack chromatographic materials for enrichments, bundled with tube adapters |
| Triethylammonium bicarbonate buffer (TEAB, 1 M, pH 8.5 (volatile)) | Sigma | 90360-100ML | |
| Trifluoroacetic acid, Reagent Grade, 99% | Fisher Scientific | 60-017-61 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-500 | |
| Trypsin/Lys-C Mix, Mass Spec Grade | Promega | V5071 | |
| Urea (Certified ACS) | Fisher Scientific | U15-500 | |
| Water, Optima LC/MS Grade | Fisher Scientific | W64 |
References
- Smith, L. M., Kelleher, N. L. Proteoform: a single term describing protein complexity. Nature Methods. 10 (3), 186-187 (2013).
- Pan, S., Brentnall, T. A., Chen, R. Glycoproteins and glycoproteomics in pancreatic cancer. World Journal of Gastroenterology. 22 (42), 9288-9299 (2016).
- Tabang, D. N., Ford, M., Li, L. Recent advances in mass spectrometry-based glycomic and glycoproteomic studies of pancreatic diseases. Frontiers in Chemistry. 9, 707387 (2021).
- Khoury, G. A., Baliban, R. C., Floudas, C. A. Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database. Scientific Reports. 1, 90 (2011).
- Alpert, A. J. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds. Journal of Chromatography A. 499, 177-196 (1990).
- Riley, N. M., Bertozzi, C. R., Pitteri, S. J. A pragmatic guide to enrichment strategies for mass spectrometry-based glycoproteomics. Molecular & Cellular Proteomics. 20, 100029 (2020).
- Low, T. Y., et al. Widening the bottleneck of phosphoproteomics: Evolving strategies for phosphopeptide enrichment. Mass Spectrometry Reviews. 40 (4), 309-333 (2021).
- Cho, K. C., Chen, L., Hu, Y., Schnaubelt, M., Zhang, H. Developing workflow for simultaneous analyses of phosphopeptides and glycopeptides. ACS Chemical Biology. 14 (1), 58-66 (2019).
- Zhou, Y., et al. An integrated workflow for global, glyco-, and phospho-proteomic analysis of tumor tissues. Analytical Chemistry. 92 (2), 1842-1849 (2020).
- Tang, R., et al. Facile preparation of bifunctional adsorbents for efficiently enriching N-glycopeptides and phosphopeptides. Analytica Chimica Acta. 1144, 111-120 (2021).
- Wang, Z., Wang, J., Sun, N., Deng, C. A promising nanoprobe based on hydrophilic interaction liquid chromatography and immobilized metal affinity chromatography for capture of glycopeptides and phosphopeptides. Analytica Chimica Acta. 1067, 1-10 (2019).
- Glover, M. S., et al. Characterization of intact sialylated glycopeptides and phosphorylated glycopeptides from IMAC enriched samples by EThcD fragmentation: Toward combining phosphoproteomics and glycoproteomics. International Journal of Mass Spectrometry. 427, 35-42 (2018).
- Alpert, A. J. Electrostatic repulsion hydrophilic interaction chromatography for isocratic separation of charged solutes and selective isolation of phosphopeptides. Analytical Chemistry. 80 (1), 62-76 (2008).
- Cui, Y., et al. Counterion optimization dramatically improves selectivity for phosphopeptides and glycopeptides in electrostatic repulsion-hydrophilic interaction chromatography. Analytical Chemistry. 93 (22), 7908-7916 (2021).
- Cui, Y., et al. Finding the sweet spot in ERLIC mobile phase for simultaneous enrichment of N-Glyco and phosphopeptides. Journal of the American Society for Mass Spectrometry. 30 (12), 2491-2501 (2019).
- Tabang, D. N., et al. Analysis of pancreatic extracellular matrix protein post-translational modifications via electrostatic repulsion-hydrophilic interaction chromatography coupled with mass spectrometry. Molecular Omics. 17 (5), 652-664 (2021).
- Huang, J., et al. Dual-functional Titanium(IV) immobilized metal affinity chromatography approach for enabling large-scale profiling of protein Mannose-6-Phosphate glycosylation and revealing its predominant substrates. Analytical Chemistry. 91 (18), 11589-11597 (2019).
- Huang, J., et al. Dual-functional Ti(IV)-IMAC material enables simultaneous enrichment and separation of diverse glycopeptides and phosphopeptides. Analytical Chemistry. 93 (24), 8568-8576 (2021).
- Jami-Alahmadi, Y., Pandey, V., Mayank, A. K., Wohlschlegel, J. A. A robust method for packing high resolution C18 RP-nano-HPLC columns. Journal of Visualized Experiments: JoVE. (171), e62380 (2021).
- Bern, M., Kil, Y. J., Becker, C. Byonic: advanced peptide and protein identification software. Current Protocols in Bioinformatics. , (2012).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).
- Zhou, Y., et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets. Nature Communications. 10 (1), 1523 (2019).
- Zacharias, L. G., et al. HILIC and ERLIC enrichment of glycopeptides derived from breast and brain cancer cells. Journal of Proteome Research. 15 (10), 3624-3634 (2016).
- Yang, W., et al. Comparison of enrichment methods for intact N- and O-linked glycopeptides using strong anion exchange and hydrophilic interaction liquid chromatography. Analytical Chemistry. 89 (21), 11193-11197 (2017).
- Toghi Eshghi, S., Shah, P., Yang, W., Li, X., Zhang, H. GPQuest: A spectral library matching algorithm for site-specific assignment of tandem mass spectra to intact N-glycopeptides. Analytical Chemistry. 87 (10), 5181-5188 (2015).
- Liu, M. -. Q., et al. pGlyco 2.0 enables precision N-glycoproteomics with comprehensive quality control and one-step mass spectrometry for intact glycopeptide identification. Nature Communications. 8 (1), 438 (2017).
- Lu, L., Riley, N. M., Shortreed, M. R., Bertozzi, C. R., Smith, L. M. O-Pair Search with MetaMorpheus for O-glycopeptide characterization. Nature Methods. 17 (11), 1133-1138 (2020).
- Caval, T., Heck, A. J. R., Reiding, K. R. Meta-heterogeneity: Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein. Molecular & Cellular Proteomics. 20, 100010 (2021).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Leutert, M., Entwisle, S. W., Villén, J. Decoding post-translational modification crosstalk with proteomics. Molecular & Cellular Proteomics. 20, 100129 (2021).
- Hart, G. W., Slawson, C., Ramirez-Correa, G., Lagerlof, O. Cross talk between O-GlcNAcylation and phosphorylation: Roles in signaling, transcription, and chronic disease. Annual Review of Biochemistry. 80 (1), 825-858 (2011).

