Стратегия обогащения спин-типом для одновременного анализа N-гликопептидов и фосфопептидов из тканей поджелудочной железы человека
Summary
Посттрансляционные модификации (PTM) изменяют структуры и функции белка. Методы одновременного обогащения нескольких типов PTM могут максимизировать охват в анализах. Представлен протокол с использованием двухфункциональной Ti(IV)-иммобилизованной хроматографии сродства металлов с последующей масс-спектрометрией для одновременного обогащения и анализа белка N-гликозилирования и фосфорилирования в тканях поджелудочной железы.
Abstract
Масс-спектрометрия может обеспечить глубокий охват посттрансляционных модификаций (ПТМ), хотя обогащение этих модификаций сложными биологическими матрицами часто необходимо из-за их низкой стехиометрии по сравнению с немодифицированными аналитами. Большинство рабочих процессов обогащения PTM на пептидах в рабочих процессах протеомики снизу вверх, где белки ферментативно перевариваются до анализа полученных пептидов, обогащают только один тип модификации. Однако именно весь набор ПТМ приводит к биологическим функциям, и обогащение одного типа ПТМ может пропустить такие перекрестные помехи ПТМ. Перекрестные помехи PTM наблюдались между гликозилированием белка и фосфорилированием, двумя наиболее распространенными ПТМ в белках человека, а также двумя наиболее изученными ПТМ с использованием рабочих процессов масс-спектрометрии. Используя стратегию одновременного обогащения, описанную в настоящем описании, оба ПТМ обогащаются из посмертной ткани поджелудочной железы человека, сложной биологической матрицы. Двухфункциональная Ti(IV)-иммобилизованная хроматография сродства металлов используется для разделения различных форм гликозилирования и фосфорилирования одновременно в нескольких фракциях в удобном методе на основе спин-наконечника, что позволяет проводить последующий анализ потенциальных перекрестных взаимодействий PTM. Этот рабочий процесс обогащения для глико- и фосфопептидов может быть применен к различным типам образцов для достижения глубокого профилирования нескольких ПТМ и выявления потенциальных молекул-мишеней для будущих исследований.
Introduction
Посттрансляционные модификации белка (PTM) играют важную роль в модуляции белковых структур и, следовательно, их функций и последующих биологических процессов. Разнообразие человеческого протеома увеличивается экспоненциально из-за комбинаторной изменчивости, обеспечиваемой различными ПТМ. Различные варианты белков из их канонических последовательностей, предсказанных геномом, известны как протеоформы, и многие протеоформы возникают из ПТМ1. Изучение протеоформного разнообразия в здоровье и болезнях стало областью исследований, представляющих большой интерес в последние годы 2,3.
Изучение протеоформ и, более конкретно, ПТМ с большой глубиной стало более поверхностным благодаря развитию методов протеомики на основе масс-спектрометрии (МС). Используя MS, аналиты ионизируются, фрагментируются и идентифицируются на основе m/z фрагментов. Методы обогащения часто необходимы из-за низкого относительного содержания ПТМ по сравнению с немодифицированными формами белков. Хотя анализ интактных белков и их ПТМ, называемый нисходящим анализом, стал более рутинным, ферментативное переваривание белков и анализ их компонентных пептидов в анализах снизу вверх по-прежнему является наиболее широко используемым путем для анализа ПТМ. Двумя наиболее широко изученными ПТМ и двумя наиболее распространенными ПТМ in vivo являются гликозилирование и фосфорилирование4. Эти два PTM играют важную роль в передаче и распознавании клеток и, таким образом, являются важными модификациями для характеристики в исследованиях заболеваний.
Химические свойства различных ПТМ часто обеспечивают пути к обогащению этих ПТМ на уровнях белка и пептида до анализа. Гликозилирование является гидрофильным ПТМ из-за обилия гидроксильных групп на каждом моносахариде. Это свойство может быть использовано для обогащения гликопептидов в гидрофильной хроматографии взаимодействия (HILIC), которая может отделять больше гидрофильных гликопептидов от гидрофобных немодифицированных пептидов5. Фосфорилирование добавляет фосфатный фрагмент, который отрицательно заряжен, за исключением кислотного рН. Благодаря этому заряду различные катионы металлов, включая титан, могут быть использованы для привлечения и связывания фосфопептидов, в то время как нефосфорилированные виды смываются. Таков принцип иммобилизованной аффинной хроматографии металлов (IMAC). Дальнейшие обсуждения этих и других стратегий обогащения для гликозилирования и фосфорилирования можно найти в недавних обзорах 6,7.
Сравнительно большие количества исходного пептидного материала (0,5 мг и более) часто необходимы для протоколов обогащения из-за низкой стехиометрии ПТМ на пептидах. В сценариях, где такое количество образца может быть нелегко получить, таких как биопсия ядра опухоли или анализ спинномозговой жидкости, полезно использовать легкие рабочие процессы, которые приводят к максимальной биомолекулярной информации. Недавние стратегии, разработанные нашей лабораторией и другими, выявили одновременный и параллельный анализ гликозилирования и фосфорилирования с использованием одного и того же рабочего процесса обогащения PTM 8,9,10,11,12. Хотя химические свойства этих двух ПТМ могут отличаться, эти ПТМ могут быть проанализированы в несколько этапов из-за инновационных методов разделения и используемых материалов. Например, электростатическая хроматография отталкивающе-гидрофильного взаимодействия (ERLIC) накладывает разделения на основе гидрофильных взаимодействий между аналитами и подвижной фазой с взаимодействием заряд-заряд между аналитами и материалом стационарной фазы 13,14,15,16. При кислом рН притяжение фосфорилированных пептидов к стационарной фазе может улучшить их удержание и отделение от немодифицированных пептидов. Материал, состоящий из Ti(IV), иммобилизованных на гидрофильных микросферах, может быть использован для элюирования на основе HILIC и IMAC для разделения фосфопептидов и нейтральных, кислых и манноз-6-фосфорилированных гликопептидов17,18. Эта стратегия известна как двухфункциональная Ti(IV)-IMAC. Использование этих стратегий для обогащения нескольких PTM в одном рабочем процессе может сделать анализ потенциальных взаимодействий перекрестных помех PTM более доступным. Кроме того, требования к общему количеству и времени отбора проб меньше, чем у обычных методов обогащения при параллельном выполнении (т.е. HILIC и IMAC на отдельных аликвотах образцов).
Чтобы продемонстрировать двухфункциональную стратегию Ti(IV)-IMAC для одновременного анализа гликозилирования и фосфорилирования белка, мы применили ее для анализа посмертных тканей поджелудочной железы человека. Поджелудочная железа вырабатывает как пищеварительные ферменты, так и регуляторные гормоны, включая инсулин и глюкагон. Функция поджелудочной железы нарушается при заболеваниях поджелудочной железы. При диабете нарушается регуляция уровня сахара в крови, что приводит к повышению уровня глюкозы в крови. При панкреатите воспаление возникает в результате аутопереваривания органа3. Изменения в профилях ПТМ, включая гликозилирование и фосфорилирование, могут привести, как это часто бывает, к другим заболеваниям.
Здесь мы описываем протокол для метода одновременного обогащения на основе спин-наконечника, основанного на двухфункциональной стратегии Ti(IV)-IMAC, для N-гликопептидов и фосфопептидов, полученных из белков, извлеченных из ткани поджелудочной железы. Протокол включает экстракцию и переваривание белка, обогащение, сбор данных MS и обработку данных, как показано на рисунке 1. Репрезентативные данные этого исследования доступны через консорциум ProteomeXchange с идентификатором PXD033065.
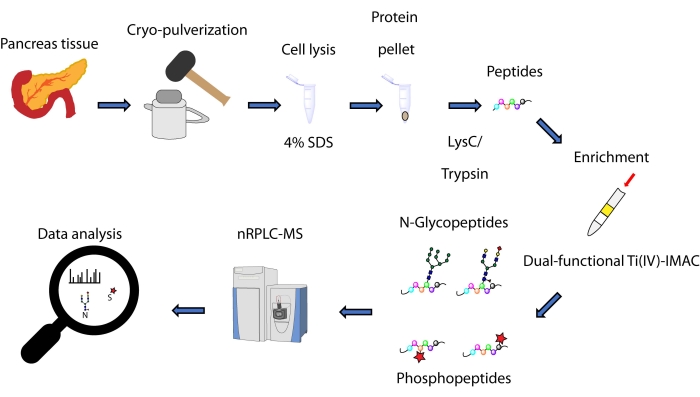
Рисунок 1: Рабочий процесс для одновременного анализа N-гликопептидов и фосфопептидов из тканей поджелудочной железы человека. Ткани сначала крио-измельчены в мелкий порошок перед экстракцией белка с использованием моющего средства додецилсульфата натрия (SDS). Затем белки подвергаются ферментативному перевариванию. Полученные пептиды аликвотируются перед обогащением с использованием двухфункционального Ti(IV)-IMAC. Необработанные данные собираются с помощью наноразмерной обратнофазной жидкостной хроматографии-масс-спектрометрии (nRPLC-MS) и анализируются с использованием программного обеспечения для поиска в базе данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Этот протокол предназначен для того, чтобы сделать анализ PTM более доступным и обеспечить более широкий анализ нескольких PTM в одном рабочем процессе. Этот протокол может быть применен к другим сложным биологическим матрицам, включая клетки и биожидкости.
Protocol
Representative Results
Discussion
Двухфункциональная стратегия Ti(IV)-IMAC полезна для одновременного анализа N-гликопептидов и фосфопептидов из одного образца в рамках одного рабочего процесса подготовки образца. Было также показано, что методы, основанные на ERLIC, выполняют одновременное обогащение ПТМ. Обе стратегии ран?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование было частично поддержано грантовым финансированием от NIH (R01DK071801, RF1AG052324, P01CA250972 и R21AG065728) и Фонда исследований ювенильного диабета (1-PNF-2016-250-S-B и SRA-2016-168-S-B). Данные, представленные здесь, также были частично получены при поддержке NIH / NCATS UL1TR002373 через Институт клинических и трансляционных исследований Университета Висконсина. Приборы Orbitrap были приобретены при поддержке гранта NIH (NIH-NCRR S10RR029531) и Офиса вице-канцлера по исследованиям и высшему образованию в Университете Висконсин-Мэдисон. Мы также хотели бы отметить щедрую поддержку Организации донорства органов и тканей Университета Висконсина, которая предоставила поджелудочную железу человека для исследований, и помощь Дэна Треммеля, доктора Сары Д. Сакетт и профессора Джона Одорико для предоставления образцов в нашу лабораторию. Наша исследовательская группа хотела бы выразить особую благодарность семьям, которые пожертвовали ткани для этого исследования. L.L. признает грант NIH S10OD025084, пилотный грант по борьбе с раком поджелудочной железы от Центра рака карбона Университета Висконсина (233-AAI9632), а также звание профессора выдающихся достижений Виласа и профессора заслуженной кафедры Чарльза Мельбурна Джонсона с финансированием, предоставленным Исследовательским фондом выпускников Висконсина и Школой фармации Университета Висконсин-Мэдисон.
Materials
| Acetic Acid, Glacial (Certified ACS) | Fisher Scientific | A38S-500 | |
| Acetone (Certified ACS) | Fisher Scientific | A18-1 | |
| Acetonitrile, Optima LC/MS Grade | Fisher Scientific | A955-4 | |
| Ammonium Acetate (Crystalline/Certified ACS) | Fisher Scientific | A637-500 | |
| Ammonium Hydroxide (Certified ACS Plus) | Fisher Scientific | A669-212 | |
| Byonic software | Protein Metrics | n/a | Commercial software used for glycoproteomic analysis (https://proteinmetrics.com/byos/) |
| C18 BEH material | Waters | 186002353 | Material removed from column and used to pack nano capillaries (pulledto integrate tip used directly in line with instrument inlet) |
| CAE-Ti-IMAC, 100% | J&K Scientific | 2749380-1G | Material used for dual-functional Ti(IV)-IMAC; can also be used for conventional IMAC/conventional phosphopeptide enrichment |
| Cellcrusher kit | Cellcrusher | n/a | Used for grinding tissue samples into powder before extraction |
| Eppendorf 5424R Microcentrifuge | Fisher Scientific | 05-401-205 | For temperature-controlled centrifugation |
| cOmplete protease inhibitor cocktail tablets | Sigma | 11697498001 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | V3151 | Protein reducing agent |
| Ethanol, 200 proof (100%), USP | Fisher | 22-032-601 | |
| Fisherbrand Analog Vortex Mixer | Fisher Scientific | 02-215-414 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (1.5 mL) | Fisher Scientific | 02-681-320 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (2 mL) | Fisher Scientific | 02-681-321 | |
| Fisherbrand Model 120 Sonic Dismembrator | Fisher Scientific | FB120110 | For sample lysis using ultrasonication |
| Formic Acid, 99.0+%, Optima LC/MS Grade | Fisher Scientific | A117-50 | |
| Fused silica capillary (75 μm inner diameter, 360 μm outer diameter) | Polymicro Technologies LLC | 100 m TSP075375 | For in-house pulled and packed columns with integrated emitter |
| Hydrofluoric acid (48 wt. % in H2O) | Sigma-Aldrich | 339261-100ML | Used for opening emitter of pulled capillary column |
| Iodoacetamide, BioUltra | Sigma | I1149-5G | Protein reducing reagent |
| MaxQuant software | n/a | n/a | Free software used for phosphoproteomic analysis (https://www.maxquant.org/) |
| Multi-therm Shaker with heating and cooling | Benchmark Scientific | H5000-HC | Heating block |
| Oasis HLB 1 cc Vac Cartridge, 10 mg Sorbent per Cartridge, 30 µm, 100/pk | Waters | 186000383 | Larger-scale cartridge desalting for tryptic digests (loading capacity approximately up to 1 mg each) |
| OMIX C18 pipette tips, 100 µL tip, 10 – 100 μL elution volume, 1 x 96 tips | Agilent | A57003100 | Smaller-scale packed pipette tip for desalting for enrichment elutions |
| P-2000 Micropipette Puller | Sutter Instrument Co. | P-2000/F | For pulling nano-capillary columns for LC-MS |
| PhosSTOP phosphatase inhibitor tablets | Sigma | 4906845001 | |
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| PolySAX LP (12 μm, pore size 300 Å) | PolyLC | BMSX1203 | Material for strong anion-exchange chromatography used for ERLIC/conventional glycopeptide enrichment |
| Potassium Phosphate Monobasic (Crystalline/Certified ACS) | Fisher Scientific | P285-500 | |
| Pressure injection cell with integrated magnetic stirplate | Next Advance | PC77-MAG | For packing nano-capillary columns with stationary phase up to 2500 psi limit |
| Proteome Discoverer software | Thermo Fisher Scientific | n/a | Commercial software for proteomics anaysis (with integrated database searching software nodes) and data visualization (https://www.thermofisher.com/us/en/home/industrial/mass-spectrometry/liquid-chromatography-mass-spectrometry-lc-ms/lc-ms-software/multi-omics-data-analysis/proteome-discoverer-software.html) |
| SpeedVac SC110 Vacuum Concentrator Model SC110-120 | Savant | n/a | Centrifugal vacuum concentrator for drying samples (under heat) |
| SDS Solution, 10% Sodium Dodecyl Sulfate Solution, Molecular Biology/Electrophoresis | Fisher Scientific | BP2436200 | |
| Sequencing Grade Modified Trypsin | Promega | V5111 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| TopTip, Empty, 10-200 µL, Pack of 96 | Glygen Corporation | TT2EMT.96 | Empty pipette tip with micron-sized hole used that can be used to pack chromatographic materials for enrichments, bundled with tube adapters |
| Triethylammonium bicarbonate buffer (TEAB, 1 M, pH 8.5 (volatile)) | Sigma | 90360-100ML | |
| Trifluoroacetic acid, Reagent Grade, 99% | Fisher Scientific | 60-017-61 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-500 | |
| Trypsin/Lys-C Mix, Mass Spec Grade | Promega | V5071 | |
| Urea (Certified ACS) | Fisher Scientific | U15-500 | |
| Water, Optima LC/MS Grade | Fisher Scientific | W64 |
References
- Smith, L. M., Kelleher, N. L. Proteoform: a single term describing protein complexity. Nature Methods. 10 (3), 186-187 (2013).
- Pan, S., Brentnall, T. A., Chen, R. Glycoproteins and glycoproteomics in pancreatic cancer. World Journal of Gastroenterology. 22 (42), 9288-9299 (2016).
- Tabang, D. N., Ford, M., Li, L. Recent advances in mass spectrometry-based glycomic and glycoproteomic studies of pancreatic diseases. Frontiers in Chemistry. 9, 707387 (2021).
- Khoury, G. A., Baliban, R. C., Floudas, C. A. Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database. Scientific Reports. 1, 90 (2011).
- Alpert, A. J. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds. Journal of Chromatography A. 499, 177-196 (1990).
- Riley, N. M., Bertozzi, C. R., Pitteri, S. J. A pragmatic guide to enrichment strategies for mass spectrometry-based glycoproteomics. Molecular & Cellular Proteomics. 20, 100029 (2020).
- Low, T. Y., et al. Widening the bottleneck of phosphoproteomics: Evolving strategies for phosphopeptide enrichment. Mass Spectrometry Reviews. 40 (4), 309-333 (2021).
- Cho, K. C., Chen, L., Hu, Y., Schnaubelt, M., Zhang, H. Developing workflow for simultaneous analyses of phosphopeptides and glycopeptides. ACS Chemical Biology. 14 (1), 58-66 (2019).
- Zhou, Y., et al. An integrated workflow for global, glyco-, and phospho-proteomic analysis of tumor tissues. Analytical Chemistry. 92 (2), 1842-1849 (2020).
- Tang, R., et al. Facile preparation of bifunctional adsorbents for efficiently enriching N-glycopeptides and phosphopeptides. Analytica Chimica Acta. 1144, 111-120 (2021).
- Wang, Z., Wang, J., Sun, N., Deng, C. A promising nanoprobe based on hydrophilic interaction liquid chromatography and immobilized metal affinity chromatography for capture of glycopeptides and phosphopeptides. Analytica Chimica Acta. 1067, 1-10 (2019).
- Glover, M. S., et al. Characterization of intact sialylated glycopeptides and phosphorylated glycopeptides from IMAC enriched samples by EThcD fragmentation: Toward combining phosphoproteomics and glycoproteomics. International Journal of Mass Spectrometry. 427, 35-42 (2018).
- Alpert, A. J. Electrostatic repulsion hydrophilic interaction chromatography for isocratic separation of charged solutes and selective isolation of phosphopeptides. Analytical Chemistry. 80 (1), 62-76 (2008).
- Cui, Y., et al. Counterion optimization dramatically improves selectivity for phosphopeptides and glycopeptides in electrostatic repulsion-hydrophilic interaction chromatography. Analytical Chemistry. 93 (22), 7908-7916 (2021).
- Cui, Y., et al. Finding the sweet spot in ERLIC mobile phase for simultaneous enrichment of N-Glyco and phosphopeptides. Journal of the American Society for Mass Spectrometry. 30 (12), 2491-2501 (2019).
- Tabang, D. N., et al. Analysis of pancreatic extracellular matrix protein post-translational modifications via electrostatic repulsion-hydrophilic interaction chromatography coupled with mass spectrometry. Molecular Omics. 17 (5), 652-664 (2021).
- Huang, J., et al. Dual-functional Titanium(IV) immobilized metal affinity chromatography approach for enabling large-scale profiling of protein Mannose-6-Phosphate glycosylation and revealing its predominant substrates. Analytical Chemistry. 91 (18), 11589-11597 (2019).
- Huang, J., et al. Dual-functional Ti(IV)-IMAC material enables simultaneous enrichment and separation of diverse glycopeptides and phosphopeptides. Analytical Chemistry. 93 (24), 8568-8576 (2021).
- Jami-Alahmadi, Y., Pandey, V., Mayank, A. K., Wohlschlegel, J. A. A robust method for packing high resolution C18 RP-nano-HPLC columns. Journal of Visualized Experiments: JoVE. (171), e62380 (2021).
- Bern, M., Kil, Y. J., Becker, C. Byonic: advanced peptide and protein identification software. Current Protocols in Bioinformatics. , (2012).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).
- Zhou, Y., et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets. Nature Communications. 10 (1), 1523 (2019).
- Zacharias, L. G., et al. HILIC and ERLIC enrichment of glycopeptides derived from breast and brain cancer cells. Journal of Proteome Research. 15 (10), 3624-3634 (2016).
- Yang, W., et al. Comparison of enrichment methods for intact N- and O-linked glycopeptides using strong anion exchange and hydrophilic interaction liquid chromatography. Analytical Chemistry. 89 (21), 11193-11197 (2017).
- Toghi Eshghi, S., Shah, P., Yang, W., Li, X., Zhang, H. GPQuest: A spectral library matching algorithm for site-specific assignment of tandem mass spectra to intact N-glycopeptides. Analytical Chemistry. 87 (10), 5181-5188 (2015).
- Liu, M. -. Q., et al. pGlyco 2.0 enables precision N-glycoproteomics with comprehensive quality control and one-step mass spectrometry for intact glycopeptide identification. Nature Communications. 8 (1), 438 (2017).
- Lu, L., Riley, N. M., Shortreed, M. R., Bertozzi, C. R., Smith, L. M. O-Pair Search with MetaMorpheus for O-glycopeptide characterization. Nature Methods. 17 (11), 1133-1138 (2020).
- Caval, T., Heck, A. J. R., Reiding, K. R. Meta-heterogeneity: Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein. Molecular & Cellular Proteomics. 20, 100010 (2021).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Leutert, M., Entwisle, S. W., Villén, J. Decoding post-translational modification crosstalk with proteomics. Molecular & Cellular Proteomics. 20, 100129 (2021).
- Hart, G. W., Slawson, C., Ramirez-Correa, G., Lagerlof, O. Cross talk between O-GlcNAcylation and phosphorylation: Roles in signaling, transcription, and chronic disease. Annual Review of Biochemistry. 80 (1), 825-858 (2011).

