تطوير نموذج فأر معلق الرباط الرحمي العجزي
Summary
يؤثر هبوط أعضاء الحوض على ملايين النساء في جميع أنحاء العالم ، ومع ذلك فإن بعض التدخلات الجراحية الشائعة لها معدلات فشل تصل إلى 40٪. عدم وجود نماذج حيوانية قياسية للتحقيق في هذه الحالة يعيق التقدم. نقترح البروتوكول التالي كنموذج لتعليق الرباط الرحمي العجزي واختبار الشد في الجسم الحي .
Abstract
هبوط أعضاء الحوض (POP) هو اضطراب شائع في قاع الحوض (PFD) مع إمكانية التأثير بشكل كبير على نوعية حياة المرأة. ما يقرب من 10 ٪ -20 ٪ من النساء يخضعن لجراحة إصلاح قاع الحوض لعلاج هبوط في الولايات المتحدة. تؤدي حالات PFD إلى تكلفة سنوية إجمالية تبلغ 26.3 مليار دولار في الولايات المتحدة وحدها. هذه الحالة متعددة العوامل لها تأثير سلبي على نوعية الحياة ، ومع ذلك فقد تضاءلت خيارات العلاج فقط في الماضي القريب. أحد الخيارات الجراحية الشائعة هو تعليق الرباط الرحمي العجزي (USLS)، والذي يتم إجراؤه عادة عن طريق تثبيت القبو المهبلي على الرباط الرحمي العجزي في الحوض. يحتوي هذا الإصلاح على نسبة أقل من المضاعفات مقارنة بتلك التي تعاني من زيادة الشبكة ، ولكنه ملحوظ لمعدل فشل مرتفع نسبيا يصل إلى 40٪. بالنظر إلى عدم وجود نماذج حيوانية قياسية لدراسة ضعف قاع الحوض ، هناك حاجة سريرية ملحة للابتكار في هذا المجال مع التركيز على تطوير نماذج حيوانية فعالة من حيث التكلفة ويمكن الوصول إليها. في هذه المخطوطة، نصف نموذجا للفئران من منتدى القيادة للمثقفين الجامعيين (USLS) يتضمن استئصال الرحم الكامل يليه تثبيت القبو المهبلي المتبقي في الرباط الرحمي العجزي. الهدف من هذا النموذج هو محاكاة الإجراء الذي يتم إجراؤه على النساء ليتمكن من استخدام النموذج ثم التحقيق في الاستراتيجيات التعويضية التي تعمل على تحسين السلامة الميكانيكية لربط الرباط. الأهم من ذلك ، أننا نصف أيضا تطوير إجراء اختبار الشد في الموقع لتوصيف سلامة الواجهة في نقاط زمنية مختارة بعد التدخل الجراحي. بشكل عام، سيكون هذا النموذج أداة مفيدة للدراسات المستقبلية التي تبحث في خيارات العلاج لإصلاح الملوثات العضوية الثابتة عبر منتدى القيادة للمثقفين الجامعيين (USLS).
Introduction
هبوط أعضاء الحوض (POP) هو اضطراب شائع في قاع الحوض يؤثر على ملايين النساء في جميع أنحاء العالم مع إمكانية التأثير بشكل كبير على العديد من جوانب حياة المرأة ، خاصة مع سن1. والجدير بالذكر أن ما يقرب من 13٪ من النساء في الولايات المتحدة سيخضعن لعملية جراحية بسبب هبوط البول أو سلس البول2. حالة أكثر شيوعا بعد الحمل والولادة ، يتميز التدلي بنزول أعضاء الحوض ، في الغالب الأجزاء المختلفة من المهبل و / أو الرحم ، بما يتجاوز وضعها الطبيعي في التجويف البريتوني. هذا يؤدي إلى أعراض مزعجة من انتفاخ المهبل أو الضغط ، والأمعاء ، والمثانة ، والعجز الجنسي ، وانخفاض نوعية الحياة بشكل عام. وتشمل عوامل الخطر الأخرى للملوثات العضوية الثابتة السمنة، وتعاطي التبغ، والسعال المزمن، والإمساك3.
في النساء الأصحاء ، يتم دعم أعضاء قاع الحوض بواسطة عضلات الرافعة ، والأربطة الرحمية العجزية (USLs) ، والأربطة الأساسية ، ومرفقات النسيج الضام بالجدار الجانبي للحوض والهياكل البعيدة للجسم العجان 4,5. تعد USLs من بين أهم الهياكل الداعمة القمية لكل من الرحم والمهبل القمي ، وبالتالي ، غالبا ما تستخدم في التصحيح الجراحي للملوثات العضوية الثابتة (الشكل 1). ينبع الدعم الهيكلي من USL من النسيج الضام الكولاجيني الكثيف في المنطقة المقدسة التي تنتقل إلى عضلات ملساء مكتظة بشكل وثيق. بسبب هذا التدرج التركيبي، يصبح USL متشابكا مع عضلات الرحم والمهبل لتوفير دعم قوي لأعضاء الحوض 6,7. في معلق الرباط الرحمي العجزي (USLS)، يتم تثبيت USLs في قبو المهبل بعد استئصال الرحم، واستعادة المهبل والهياكل المحيطة إلى وضعها التشريحي في مقصورة البطن. ومع ذلك، وبغض النظر عن المسار عبر المهبل أو بالمنظار، فإن إجراء منتدى القيادة للمثقفين الجامعيين (USLS) يعاني من معدل فشل مرتفع نسبيا يصل إلى 40٪ في بعض الدراسات 8,9. كان معدل تكرار أعراض الانتفاخ المهبلي المزعجة بعد 5 سنوات من الإصلاح لهبوط الحيز القمي ، مثل USLs ، حوالي 40٪ في تجربة معشاة ذات شواهد كبيرة متعددة المراكز9. في نفس التجربة ، كانت إعادة العلاج للهبوط المتكرر في 5 سنوات حوالي 10 ٪. لم تتم دراسة آلية معدل الفشل المرتفع هذا، ولكن استعادة المهبل والهياكل المحيطة به إلى وضعها التشريحي يتطلب وضع خياطة في منطقة الكولاجين الكثيفة في USL10,11 بدلا من منطقة العضلات الملساء. لذلك، يمكن أن يكون معدل الفشل المرتفع ناتجا عن عدم التطابق الميكانيكي والتركيبي لواجهة USL المهبلية المشكلة جراحيا مقارنة بالتكامل الكامل الذي شوهد في ملحق عنق الرحم و USL الأصلي.
التأثير الاقتصادي لعلاج هذه الاضطرابات ملحوظ أيضا ، حيث يتم إنفاق ما يقرب من 300 مليون دولار سنويا في الولايات المتحدة على الرعاية الإسعافية12 ، وأكثر من مليار دولار يتم إنفاقها سنويا في التكاليف المباشرة للعمليات الجراحية13. على الرغم من الموارد الاقتصادية الهائلة المخصصة لعلاج هذه الحالات ، إلا أن المضاعفات الناشئة عن العديد من جراحات الهبوط لا تزال محبطة. على سبيل المثال ، تقدم إصلاحات التدلي القمي القائمة على شبكة البولي بروبلين ، مثل sacrocolpopexy ، معدلات نجاح أعلى مقارنة بإصلاحات الأنسجة الأصلية14 ، ولكن على حساب المضاعفات المحتملة مثل التعرض للشبكة أو التآكل. تلقت إدارة الغذاء والدواء ما يقرب من 3000 شكوى تتعلق بمضاعفات الشبكة بين عامي 2008 و 2010 وحدها. وبلغ هذا ذروته في أمر من إدارة الغذاء والدواء لوقف تصنيع وبيع جميع المنتجات الشبكية الموضوعة عبر المهبل للملوثات العضوية الثابتة في أبريل 201915. لذلك ، هناك حاجة سريرية قوية لمواد أخرى غير البولي بروبلين ، ونماذج لاختبارها ، والتي قد تزيد من إصلاحات هبوط الأنسجة الأصلية وتزيد من معدلات النجاح مقارنة بالتقنيات التقليدية مع الخياطة وحدها.
منذ إعلان إدارة الغذاء والدواء الأمريكية في عام 2019 ، توقف معظم جراحي الحوض عن استخدام الشبكة الموضوعة عبر المهبل لإصلاح التدلي ، مما دفع الباحثين إلى البحث عن مناهج جديدة لهندسة الأنسجة لزيادة إصلاحات الأنسجة الأصلية 16،17،18 مثل خلايا انسجة اللحمة المتوسطة (MSCs)9,20 . مع هذا التحول في التركيز ، هناك حاجة ملحة لتحسين النماذج الحيوانية التي يمكن أن تساعد في تطوير مواد جديدة. التحدي في هذه العملية هو تحقيق التوازن بين الأهمية السريرية والتكلفة. تحقيقا لهذه الغاية ، استفاد الباحثون الأساسيون والسريريون الذين يدرسون هبوط أعضاء الحوض من العديد من النماذج الحيوانية حتى الآن ، بما في ذلك الجرذان والفئران والأرانب والأغنام والخنازير والرئيسيات غير البشرية19. تعد عملية تحديد نموذج حيواني مثالي أمرا صعبا ، حيث أن البشر على قدمين ، وليس لديهم ذيل ، ولديهم عملية ولادة مؤلمة مقارنة بأنواع الثدييات الأخرى20. تم استخدام الخنازير21 لمحاكاة تثبيت العجزي الروبوتي ، بينما تم استخدام الأغنام لمحاكاة إصلاحات هبوط المهبل22. هذه النماذج الحيوانية ، على الرغم من أهميتها سريريا ، محدودة الجدوى من حيث التكلفة والصيانة. وقد استخدمت الرئيسيات غير البشرية لدراسة التسبب في هبوط. السنجاب على وجه الخصوص هي واحدة من الأنواع الوحيدة بخلاف البشر التي يمكن أن تتطور هبوطا تلقائيا ، مما يجعلها واحدة من أكثر النماذج الحيوانية ذات الصلة20. كما تم استخدام الرئيسيات غير البشرية لدراسة العمليات الجراحية النسائية مثل sacrocolpopexy23 وزرع الرحم24. على غرار نظرائهم من الأغنام والخنازير ، فإن القيد الأساسي للرئيسيات غير البشرية كنموذج حيواني للهبوط هو تكلفة الصيانة والرعاية والصعود19.
على الرغم من أن حوض القوارض موجه أفقيا مع نسبة أصغر بكثير من حجم قناة الرأس إلى الولادة مقارنة بالبشر19، إلا أن الفئران مناسبة للدراسات على الحيوانات الصغيرة لجراحة USLS نظرا لأن لها نفس تشريح USL والخلوية والبنية النسيجية وتكوين المصفوفة مقارنة ب USL25 البشري. علاوة على ذلك ، فهي مفيدة من حيث الصيانة والصعود. على الرغم من هذه السمات المفيدة، لا توجد تقارير منشورة عن نموذج فئران لإصلاح منتدى القيادة للمثقفين الجامعيين (USLS). لذلك ، فإن الهدف هو وصف بروتوكول لاستئصال الرحم و USLS في فأر لويس متعدد الأزواج. سيكون هذا البروتوكول مفيدا للباحثين الذين يهدفون إلى دراسة الفيزيولوجيا المرضية والمكونات الجراحية للملوثات العضوية الثابتة باستخدام هذا النموذج الحيواني الذي يمكن الوصول إليه.
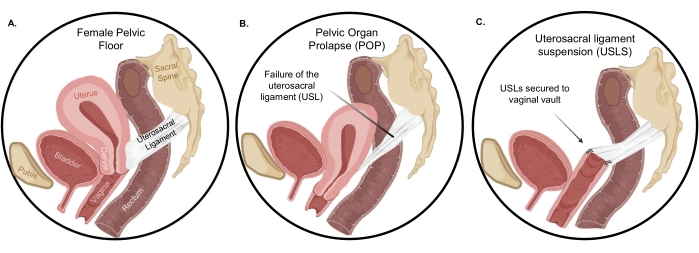
الشكل 1: هبوط أعضاء الحوض. أ: الاتجاه الطبيعي للأعضاء في التجويف البريتوني، ب: النزول الدراماتيكي للعضو عند حدوث التدلي. بعد استئصال الرحم، يعيد معلق الرباط الرحمي العجزي المهبل والتراكيب المحيطة به إلى موضعها التشريحي الصحيح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
يتميز البروتوكول بالعديد من المزايا. على حد علمنا، هذا هو أول وصف منشور لمنتدى القيادة للمثقفين الجامعيين (USLS) في نموذج الفئران، وسوف يزود الباحثين المستقبليين بخطوات قابلة للتكرار لتنفيذ هذا الإجراء في بيئة البحث. ثانيا، قمنا بتضمين بروتوكول جديد لاختبار الشد للواجهة الأصلية والجراحية ل USL. يمكن استخدام بروتوكول اختبار الشد في دراسات مماثلة تبحث في مناهج هندسة الأنسجة الجديدة لزيادة إصلاحات الأنسجة الأصلية مثل USLS. علاوة على ذلك ، فإن نموذج الفئران نفسه مفيد لدراسة اضطرابات قاع الحوض بسبب سهولة التعامل / الصعود ، والعمر القصير ، وفعالية التكلفة مقارنة بالنماذج الحيوانية الأكبر. تشمل قيود البروتوكول عدم القدرة على تقييم أحد المضاعفات الرئيسية للمثقفين الجامعيين الجامعيين، وهو التواء الحالب. على الرغم من ذلك ، لم يكن لدينا أي حالات إصابة حالب مفترضة في هذه الدراسة. هناك اعتبار آخر هو أن الاتجاه الأفقي للحوض ، ونسبة قناة رأس الجنين إلى الولادة الصغيرة ، وعدم وجود هبوط تلقائي في نموذج الفئران يحد من بعض قابلية تطبيق النتائج على البشر. ومع ذلك، فإن استخدام الفئران متعددة الشقوق هو أحد نقاط قوة هذه الدراسة لأن هذا يمثل عامل الخطر الرئيسي في تطور الملوثات العضوية الثابتة3.
سيكون إنشاء بروتوكول ناجح لاستئصال الرحم ومنتدى القيادة للمثقفين الجامعيين (USLS) في فأر لويس أداة مفيدة للباحثين المستقبليين الذين يبحثون في المكونات الجراحية للملوثات العضوية الثابتة، مع تقليل التباين في اختبار السلوك الميكانيكي ل USL. النماذج الحيوانية الجراحية مفيدة من حيث أنها تسمح للباحثين بتصميم تجارب ذات صلة سريريا تتحكم في التكافؤ وكتلة الجسم والمرض والتغذية34 مع التخفيف من المخاطر الأخلاقية للدراسة الأولية على البشر. علاوة على ذلك ، تسمح النماذج الموحدة للملوثات العضوية الثابتة للباحثين بتجاوز قيود جمع الأنسجة البشرية. على وجه الخصوص ، ستمكن طرق اختبار الشد الموضحة في هذا البروتوكول من الاتساق بين الدراسات. اختبرت نماذج القوارض السابقة الخواص الميكانيكية لمنطقة الحوض بأكملها ، والتي تشمل عنق الرحم والمهبل وأربطة دعم الحوضالمتعددة 29,42. تسمح الطرق الموضحة هنا بقياس USL بطريقة تحافظ على مرفقات العمود الفقري وعنق الرحم الأصلية. وتجدر الإشارة إلى أن طرق اختبار الشد لا تقيم USL وحدها، بل تقيم USL بالاقتران مع إدخاله في العجز وعنق الرحم. هذه هي قوة الدراسة لأنها تعكس القوى المعتادة في الموقع التي يتعرض لها الرباط. نحن نقر بأن السلوك الميكانيكي للرباط المعزول سيكون مختلفا إذا تم اختباره خارج الجسم الحي بدون ملحقاته الأصلية. هذا صحيح بشكل خاص لأن هياكل الفئران صغيرة وتحد من جدوى جمع عينة مناسبة للاختبار خارج الجسم الحي. تواجه USLs التحميل في اتجاهات متعددة في الموقع، لذا فإن الطبيعة أحادية المحور للاختبار هي قيد، ولكن استخدام هذه الطريقة يسمح بإجراء مقارنات ذات مغزى بين الدراسات السابقة لميكانيكا USL للفئران29,42. على الرغم من عدم وجود بروتوكول اختبار ميكانيكي قياسي مقبول على نطاق واسع ، إلا أن هذا النموذج سيكون أداة مفيدة لدراسات هندسة الأنسجة المستقبلية في هذا المجال.
تعتبر العديد من الخطوات الموضحة في هذا البروتوكول ضرورية لصحة الحيوانات ورفاهيتها بالإضافة إلى إمكانية استنساخ جراحة USLS واختبارات الشد اللاحقة. أولا ، من الضروري الحصول على كل من الأدوية المسكنة والمضادة للالتهابات الموصوفة بأنها مسكن وحده وجد أنه غير كاف لإدارة الألم. يقلل المضاد الحيوي الوقائي من خطر الإصابة بعدوى موقع الجراحة وهو معيار الرعاية في الجراحة البشرية. فيما يتعلق بالإجراء الجراحي للمثقفين الجامعيين الجامعيين (USLS)، فإن تجنب تلف المبيضين وتقليل فقدان الدم أمران ضروريان لإجراء عملية جراحية ناجحة. تصف الخطوتان 1.3.3 و 1.3.4 فصل الجزء العلوي من قرن الرحم عن المبيض المجاور ؛ يجب توخي الحذر للحفاظ على هذا التشريح على جانب قرن الرحم لمنع تعطيل الأوعية الحساسة حول المبيض ، مما قد يؤدي إلى نزيف مفرط. وتجدر الإشارة إلى أن محققين آخرين أظهروا أن وظيفة المبيض يتم الحفاظ عليها بعد إزالة قرون الرحم43. علاوة على ذلك ، إذا تعطلت المبايض أو أزيلت ، فسوف تنزعج بنية ألياف الكولاجين الكلية ، مما يؤدي إلى تغيير الخواص الميكانيكية لأنسجتها44,45. بمجرد فصل قرن الرحم بأمان عن المبيض ، هناك مستوى واضح من التشريح يسمح بعزل قرن الرحم عن منصات الدهون والأوعية الدموية المحيطة. على الرغم من مستوى التشريح الواضح ، يجب تأمين عنيق على طول قرن الرحم بمشبك قبل الاستئصال بمقص صغير. على عكس الممارسة الجراحية في البشر ، وجدنا أن ربط خياطة عنيق استئصال الرحم غير ضروري ، لأن تثبيت عنيق قبل النقل يضمن الإرقاء المناسب. تصف الخطوة 1.3.6 من البروتوكول هذه العملية الدقيقة لتقليل فقدان الدم. أثناء إجراء استئصال الرحم ، يجب توخي الحذر الشديد لتحديد الحالب كما هو مذكور في الخطوتين 1.3.6 و 1.3.8. يعد فهم القرب التشريحي للحالب أمرا بالغ الأهمية، حيث أن إحدى المضاعفات الأكثر شيوعا المرتبطة ب USLs في البشر هي إصابة الحالب46.
في الختام ، نقدم بروتوكولا جديدا لإجراء استئصال الرحم ، وتعليق الرباط الرحمي العجزي ، واختبار الشد ل USL في نموذج الفئران. نتوقع أن تساعد النتائج التي توصلنا إليها الباحثين في العلوم الأساسية في المستقبل من خلال تقديم وصف واضح وقابل للتكرار لهذه الإجراءات وبالتالي السماح بتقدم أبحاث هبوط أعضاء الحوض.
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر البروفيسور سيلفيا بليمكر على استخدام Instron الخاص بها والبروفيسور جورج المسيح لاستخدام مساحته الجراحية بالإضافة إلى حامل وقبضة مطبوعة 3D. تم دعم هذا العمل من قبل شراكة الأبحاث الانتقالية UVA-Coulter ووزارة الدفاع (W81XWH-19-1-0157).
Materials
| Alcohol prep pad | BD | 326895 | |
| Artificial Tear Ointment | American Health Service Sales Corp | PH-PARALUBE-O | |
| Bluehill software | Instron | Bluehill 3 | |
| Cavicide 1 disinfectant | Fisher Scientific | 22 998 800 | |
| Compression platean | Instron | 2501-163 | |
| Cotton swabs | Puritan Medical | 806-WC | |
| Gauze Sponge, 8-Ply | VWR | 95038-728 | |
| Mosquito Forceps | Medline Industries | MMDS1222115 | |
| Needle Holder | Medline Industries | DYND04045 | |
| Operating Scissors, 5½", Sharp | American Health Service Sales Corp | 4-222 | |
| Opioid Analgesic (Buprenorphine XR) | Fidelis Animal Health | Ethiqa XR | 0.65 mg/kg SC Q72 |
| NSAID Analgesic (Meloxicam SR) | Wildlife Pharmaceuticals, LLC | Meloxicam SR | 1 mg/kg SC q72 |
| PDS II, 3-0 Polydioxanone Suture, SH-1 | Ethicon | Z316H | |
| PDS II, 5-0 P olydioxanone Suture, RB-1 | Ethicon | Z303H | |
| Retractor | Medline Industries | MDS1862107 | |
| Scalpel Blade Stainless Surgical #10 | Miltex | 4-310 | |
| Scalpel Handle | Medline Industries | MDS15210 | |
| Scissor, Micro, Curved, 4.5" | Westcott | MDS0910311 | |
| Single Column Universal Testing System | Instron | 5943 S3873 | 1 kN force capacity, 10 N load cell |
| Sterile Natural Rubber Latex Gloves | Accutech | 91225075 | |
| Suture,Vicryl,6-0,P-3 | Ethicon | J492G | |
| Tape,Umbilical,Cotton,1/8X18" | Ethicon | U10T | |
| Tension and Compression Load Cell | Instron | 2530-10N | 10N load cell (1 kgf, 2 lbf) |
| Veterinary surgical adhesive (skin glue) | Covetrus | 31477 |
References
- Olsen, A. L., et al. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstetrics and Gynecology. 89 (4), 501-506 (1997).
- Wu, J. M., et al. Lifetime risk of stress urinary incontinence or pelvic organ prolapse surgery. Obstetrics and Gynecology. 123 (6), 1201-1206 (2014).
- Kenton, K., Mueller, E. R. The global burden of female pelvic floor disorders. BJU International. 98, 1-7 (2006).
- Herschorn, S. Female pelvic floor anatomy The pelvic floor, supporting structures, and pelvic organs. Reviews in Urology. 6, 2-10 (2004).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 369 (9566), 1027-1038 (2007).
- Campbell, R. M. The anatomy and histology of the sacrouterine ligaments. American Journal of Obstetrics and Gynecology. 59 (1), 1-12 (1950).
- Reisenauer, C., et al. The role of smooth muscle in the pathogenesis of pelvic organ prolapse – An immunohistochemical and morphometric analysis of the cervical third of the uterosacral ligament. International Urogynecology Journal and Pelvic Floor Dysfunction. 19 (3), 383-389 (2008).
- Lavelle, R. S., Christie, A. L., Alhalabi, F., Zimmern, P. E. Risk of prolapse recurrence after native tissue anterior vaginal suspension procedure with intermediate to long-term followup. Journal of Urology. 195 (4), 1014-1020 (2016).
- Jelovsek, J. E., et al. Effect of uterosacral ligament suspension vs sacrospinous ligament fixation with or without perioperative behavioral therapy for pelvic organ vaginal prolapse on surgical outcomes and prolapse symptoms at 5 years in the OPTIMAL randomized clinical trial. JAMA – Journal of the American Medical Association. 319 (15), 1554-1565 (2018).
- Bradley, M. S., et al. Vaginal uterosacral ligament suspension: A retrospective cohort of absorbable and permanent suture groups. Female Pelvic Medicine & Reconstructive Surgery. 24 (3), 207-212 (2018).
- Cola, A., et al. Native-tissue prolapse repair: Efficacy and adverse effects of uterosacral ligaments suspension at 10-year follow up. International Journal of Gynecology and Obstetrics. , (2022).
- Sung, V. W., Washington, B., Raker, C. A. Costs of ambulatory care related to female pelvic floor disorders in the United States. American Journal of Obstetrics and Gynecology. 202 (5), 1-4 (2010).
- Subak, L. L., et al. Cost of pelvic organ prolapse surgery in the United States. Obstetrics and Gynecology. 98 (4), 646-651 (2001).
- Siddiqui, N. Y., et al. Mesh sacrocolpopexy compared with native tissue vaginal repair: A systematic review and meta-analysis. Obstetrics & Gynecology. 125 (1), 44-55 (2015).
- FDA takes action to protect women’s health, orders manufacturers of surgical mesh intended for transvaginal repair of pelvic organ prolapse to stop selling all devices. FDA News Release Available from: https://www.fda.gov/news-events/press-announcements/fda-takes-action-protect-womens-health-orders-manufacturers-surgical-mesh-intended-transvaginal (2019)
- Brincat, C. A. Pelvic organ prolapse reconsidering treatment, innovation, and failure. JAMA – Journal of the American Medical Association. 322 (11), 1047-1048 (2019).
- Cundiff, G. W. Surgical innovation and the US Food and Drug Administration. Female Pelvic Medicine & Reconstructive Surgery. 25 (4), 263-264 (2019).
- Luchristt, D., Weidner, A. C., Siddiqui, N. Y. Urinary basement membrane graft-augmented sacrospinous ligament suspension: a description of technique and short-term outcomes. International Urogynecology Journal. 33 (5), 1347-1350 (2022).
- Couri, B. M., et al. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics and Gynecology. 7 (3), 249-260 (2012).
- Mori da Cunha, M. G. M. C., et al. Animal models for pelvic organ prolapse: systematic review. International Urogynecology Journal. 32 (6), 1331-1344 (2021).
- Kasabwala, K., Goueli, R., Culligan, P. J. A live porcine model for robotic sacrocolpopexy training. International Urogynecology Journal. 30 (8), 1371-1375 (2019).
- Mansoor, A., et al. Development of an ovine model for training in vaginal surgery for pelvic organ prolapse. International Urogynecology Journal. 28 (10), 1595-1597 (2017).
- Liang, R., et al. Impact of prolapse meshes on the metabolism of vaginal extracellular matrix in rhesus macaque. American Journal of Obstetrics and Gynecology. 212 (2), 1-7 (2015).
- Johannesson, L., et al. Preclinical report on allogeneic uterus transplantation in non-human primates. Human Reproduction. 28 (1), 189-198 (2013).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- National Research Council. . Guide for the Care and Use of Laboratory Animals: Eighth Edition. , (2011).
- Federal Animal Welfare Regulations. National Archives Available from: https://www.ecfr.gov/current/title-9/chapter-l/subchapter-A/part-2/subpart-C/section-2.31 (2022)
- Ma, Y., et al. Knockdown of Hoxa11 in vivo in the uterosacral ligament and uterus of mice results in altered collagen and matrix metalloproteinase activity. Biology of Reproduction. 86 (4), 100 (2012).
- Moalli, P. A., et al. A rat model to study the structural properties of the vagina and its supportive tissues. American Journal of Obstetrics and Gynecology. 192 (1), 80-88 (2005).
- Yoshida, K., et al. Mechanics of cervical remodelling: Insights from rodent models of pregnancy. Interface Focus. 9 (5), 20190026 (2019).
- Christ, G. J., Sharma, P., Hess, W., Bour, R. . Modular biofabrication platform for diverse tissue engineering applications and related method thereof. , (2020).
- Smith, K., Christ, G. J. . Incorporation of in vitro double seeding for enhanced development of tissue engineered skeletal muscle implants. , (2019).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Baah-Dwomoh, A., McGuire, J., Tan, T., De Vita, R. Mechanical properties of female reproductive organs and supporting connective tissues: A review of the current state of knowledge. Applied Mechanics Reviews. 68 (6), 1-12 (2016).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Kurtaliaj, I., Golman, M., Abraham, A. C., Thomopoulos, S. Biomechanical testing of murine tendons. Journal of Visualized Experiments. (152), e60280 (2019).
- Griffin, M., et al. Biomechanical characterization of human soft tissues using indentation and tensile testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Feola, A., et al. Parity negatively impacts vaginal mechanical properties and collagen structure in rhesus macaques. American Journal of Obstetrics and Gynecology. 203 (6), 1-8 (2010).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics and Gynecology and Reproductive Biology. 144, 146-158 (2009).
- Lowder, J. L., et al. Adaptations of the rat vagina in pregnancy to accommodate delivery. Obstetrics and Gynecology. 109 (1), 128-135 (2007).
- Koebele, S. V., et al. Hysterectomy uniquely impacts spatial memory in a rat model: A role for the nonpregnant uterus in cognitive processes. Endocrinology. 160 (1), 1-19 (2019).
- Kafantari, H., et al. Structural alterations in rat skin and bone collagen fibrils induced by ovariectomy. Bone. 26 (4), 349-353 (2000).
- Daghma, D. E. S., et al. Computational segmentation of collagen fibers in bone matrix indicates bone quality in ovariectomized rat spine. Journal of Bone and Mineral Metabolism. 36 (3), 297-306 (2018).
- Manodoro, S., Frigerio, M., Milani, R., Spelzini, F. Tips and tricks for uterosacral ligament suspension: how to avoid ureteral injury. International Urogynecology Journal. 29 (1), 161-163 (2018).

